神経伝達物質の放出はシナプス前末端に存在する電位依存性Ca2+チャネルを介してCa2+が流入することによって引き起こされる。Ca2+チャネルはその薬理学的性質や電気生理学的性質によりT型、L型、N型、P/Q型、R型に分類されている。哺乳類の中枢神経系では、一般にこれらのCa2+チャネルのうちN型、P/Q型、R型のCa2+チャネルが神経伝達物質の放出に関与することが知られているが、これらめCa2+チャネルの生後発達に伴う変化に関してはこれまでに報告がなされていない。本研究では、異なる日齢のラットの脳幹、小脳、視床、大脳皮質、脊髄の薄切スライスからシナプス後電流を記録し、Ca2+チャネルのタイプに特異的なブロッカーの抑制効果を測定することにより、生後発達に伴うシナプス前末端Ca2+チャネルの変化について検討した。 はじめに、聴覚路で方向覚に重要な役割を果たす鍋牛神経前腹側核一台形体内側核間の興奮性シナプスを用いて検討を行った。厚さ250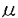 mの脳幹の水平断スライスを作製し、台形体内側核の主細胞よりパッチクランプホールセル記録を行い、-70mVに電位固定した。刺激には正中と台形体内側核との中間に配置した双極性刺激電極を用いて台形体を刺激し、グルタミシ酸作動性の興奮性シナプス後電流(EPSC)を誘発した。生後7日目におけるEPSCは、N型Ca2+チャネルの特異的なブロッカー mの脳幹の水平断スライスを作製し、台形体内側核の主細胞よりパッチクランプホールセル記録を行い、-70mVに電位固定した。刺激には正中と台形体内側核との中間に配置した双極性刺激電極を用いて台形体を刺激し、グルタミシ酸作動性の興奮性シナプス後電流(EPSC)を誘発した。生後7日目におけるEPSCは、N型Ca2+チャネルの特異的なブロッカー -conotoxinGVIA( -conotoxinGVIA( -CgTx;2 -CgTx;2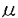 M)の潅流投与によって約35%非可逆的に抑制され、残りの部分は、P/Q型Ca2+チャネル特異的なブロツカー M)の潅流投与によって約35%非可逆的に抑制され、残りの部分は、P/Q型Ca2+チャネル特異的なブロツカー -Agatoxin-IVA( -Agatoxin-IVA( -Aga-IVA;200 -Aga-IVA;200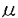 M)の投与により非可逆的に抑制された。したがって、この日齢ではN型とP/Q型両方のCa2+チャネルがシナプス伝達に関与していることが示唆される。しかし、 M)の投与により非可逆的に抑制された。したがって、この日齢ではN型とP/Q型両方のCa2+チャネルがシナプス伝達に関与していることが示唆される。しかし、 -CgTxのEPSC-に対する抑制効果は生後発達に伴い急激に減少し、生後10日目以降完全に消失した。これとは対照的に -CgTxのEPSC-に対する抑制効果は生後発達に伴い急激に減少し、生後10日目以降完全に消失した。これとは対照的に -Aga-IVAの抑制効果は生後発達に伴い増大した。L型Ca2+チャネルブロッカーnicardipine(10 -Aga-IVAの抑制効果は生後発達に伴い増大した。L型Ca2+チャネルブロッカーnicardipine(10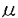 M)の効果はいずれの年齢でも認められなかった。以上の結果から、シナプス形成初期にはN型とP/Q型のCa2+チャネルが共にシナプス伝達に関与するが、シナプスの成熟に伴ってN型Ca2+チャネルの関与が減少し、専らP/Q型がシナプス伝達を媒介するようになると考えられる。 M)の効果はいずれの年齢でも認められなかった。以上の結果から、シナプス形成初期にはN型とP/Q型のCa2+チャネルが共にシナプス伝達に関与するが、シナプスの成熟に伴ってN型Ca2+チャネルの関与が減少し、専らP/Q型がシナプス伝達を媒介するようになると考えられる。 シナプス伝達に対するN型Ca2+チャネルの関与が発達とともに減少する原因として、1)シナプス前末端のN型Ca2+チャネルの消失、2)N型Ca2+チャネルと開口放出装置との解離、の2つの可能性が考えられる。これらのうちいずれの変化が生じているのかを明らかにする目的で、台形体内側核の巨大シナプス前末端Calyx of Heldより直接ホールセル記録を行い、シナプス前末端のCa2+電流を記録した。Ca2+電流は、Na+電流をtetrodotoxin(1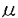 M)により、K+電流をtetraethylammonium(10mM)によりブロックした状態で保持電位-80mVから10mVに10ms間脱分極させることにより記録した。生後7日目のcalyxのCa2+電流は、 M)により、K+電流をtetraethylammonium(10mM)によりブロックした状態で保持電位-80mVから10mVに10ms間脱分極させることにより記録した。生後7日目のcalyxのCa2+電流は、 -CgTxの投与により30%、 -CgTxの投与により30%、 -Aga-IVAの投与により55%抑制され、残りの成分(15%)は電位依存性Ca2+チャネル全般のブロッカーであるCd2+(100 -Aga-IVAの投与により55%抑制され、残りの成分(15%)は電位依存性Ca2+チャネル全般のブロッカーであるCd2+(100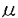 M)により完全に抑制された。しかし発達とともに M)により完全に抑制された。しかし発達とともに -CgTxのCa2+電流に対する抑制効果は減少し、生後13日目に -CgTxのCa2+電流に対する抑制効果は減少し、生後13日目に -CgTxの抑制効果は消失した。一方、 -CgTxの抑制効果は消失した。一方、 -Aga-IVAのCa2+電流に対する抑制効果は発達とともに増大し、生後13日目のCa2+電流は -Aga-IVAのCa2+電流に対する抑制効果は発達とともに増大し、生後13日目のCa2+電流は -Aga-IVAによりほぼ完全に抑制された。これらの結果は、生後早期にシナプス前末端に存在するN型、R型Ca2+チャネルが発達とともに消失し、P/Q型Ca2+チャネルのみに置換されることを示している。 -Aga-IVAによりほぼ完全に抑制された。これらの結果は、生後早期にシナプス前末端に存在するN型、R型Ca2+チャネルが発達とともに消失し、P/Q型Ca2+チャネルのみに置換されることを示している。 次に、このような生後発達に伴うCa2+チャネルタイプのスイッチが他の中枢シナプスにおいても起こっている可能性を検討した。小脳では、抑制性シナプスを用いてシナプス伝達に関与するCa2+チャネルの生後変化について検討した。厚さ200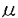 mの小脳の矢状断スライスを作製し、深部小脳核の神経細胞よりホールセル記録を行い、プルキンエ細胞-深部小脳核間のGABA作動性の抑制性シナプス後電流(IPSC)を記録した。IPSCはNaCl(1M)を含むガラス電極を用いてプルキンエ細胞の軸索を刺激することにより誘発した。生後7日目において、深部小脳核のIPSCは mの小脳の矢状断スライスを作製し、深部小脳核の神経細胞よりホールセル記録を行い、プルキンエ細胞-深部小脳核間のGABA作動性の抑制性シナプス後電流(IPSC)を記録した。IPSCはNaCl(1M)を含むガラス電極を用いてプルキンエ細胞の軸索を刺激することにより誘発した。生後7日目において、深部小脳核のIPSCは -CgTxの投与により約50%抑制され、残りの成分は -CgTxの投与により約50%抑制され、残りの成分は -Aga-IVAの投与により大部分が抑制された。しかし、一生後発達とともにIPSCに対する -Aga-IVAの投与により大部分が抑制された。しかし、一生後発達とともにIPSCに対する -CgTxの抑制効果は減少し、生後16日目に-おいて -CgTxの抑制効果は減少し、生後16日目に-おいて -CgTxのIPSCに対する抑制効果は消失した。一方、 -CgTxのIPSCに対する抑制効果は消失した。一方、 -CgTx投与後に残ったIPSCはいずれの年齢でも -CgTx投与後に残ったIPSCはいずれの年齢でも -Aga-IVAの投与によってほぼ完全に抑制された。このことから小脳のシナプスにおいても脳幹の興奮性シナプスと同様に生後発達に伴ってシナプス前末端のN型Ca2+チャネルが消失すると推定される。 -Aga-IVAの投与によってほぼ完全に抑制された。このことから小脳のシナプスにおいても脳幹の興奮性シナプスと同様に生後発達に伴ってシナプス前末端のN型Ca2+チャネルが消失すると推定される。 次に視床の矢状断スライスを作製し、外側背側核のrelay neuronよりホールセル記録を行い、視床網様核から外側背側核杖のGABA作動性の抑制性シナプスでIPSCを記録した。IPSCは視床網様核の軸索を刺激して誘発した。生後10日目では、視床外側背側核のIPSCは -CgTxの投与により約45%抑制されたが、生後19日目に -CgTxの投与により約45%抑制されたが、生後19日目に -CgTxの抑制効果は消失した。 -CgTxの抑制効果は消失した。 -CgTx非感受性のIPSCは、いずれの日齢でも -CgTx非感受性のIPSCは、いずれの日齢でも -Aga-IVAの投与によりほぼ完全に抑制された。このことから、視床の抑制性シナプス前末端でも脳幹の興奮性シナプス、小脳の抑制性シナプスと同様のCa2+チャネルタイプの変化が生じているものと考えられる。 -Aga-IVAの投与によりほぼ完全に抑制された。このことから、視床の抑制性シナプス前末端でも脳幹の興奮性シナプス、小脳の抑制性シナプスと同様のCa2+チャネルタイプの変化が生じているものと考えられる。 シナプス後電流に対する -CgTXの抑制効果の減少は、1)伝達物質の放出量がシナプス後部受容体に対して飽和している場合や2)シナプス前末端に流入するCa2+の量が伝達物質放出装置のCa2+センサーに対して飽和している場合にも生じうる。これらの可能性を除外する目的で、細胞外液の[Ca2+]/[Mg2+]を2mM/1mMから1mM/2mMに低下させ、伝達物質の放出確率を充分に低下させた状態で、小脳、視床のIPSCに対する -CgTXの抑制効果の減少は、1)伝達物質の放出量がシナプス後部受容体に対して飽和している場合や2)シナプス前末端に流入するCa2+の量が伝達物質放出装置のCa2+センサーに対して飽和している場合にも生じうる。これらの可能性を除外する目的で、細胞外液の[Ca2+]/[Mg2+]を2mM/1mMから1mM/2mMに低下させ、伝達物質の放出確率を充分に低下させた状態で、小脳、視床のIPSCに対する -CgTxの効果を検討した。生後17日目の小脳IPSC,生後20日目の視床IPSCはいずれも、[Ca2+]/[Mg2+]を低下させた状態でも -CgTxの効果を検討した。生後17日目の小脳IPSC,生後20日目の視床IPSCはいずれも、[Ca2+]/[Mg2+]を低下させた状態でも -CgTxの投与により抑制されなかった。 -CgTxの投与により抑制されなかった。 次に、大脳皮質視覚野の矢状断スライスを作製し、視覚野第IV層の錐体細胞よりホールセル記録を行い、視床-大脳皮質間のグルタミン酸作動性EPSCを記録した。EPSCは視覚野第VI層と白質の中間部で視床から大脳皮質に至る軸索を刺激して誘発した。生後10日目の大脳皮質のEPSCは -CgTxの投与により約60%抑制され、 -CgTxの投与により約60%抑制され、 -CgTx非感受性成分は -CgTx非感受性成分は -Aga-IVAの投与によりほぼ完全に抑制された。しかし、脳幹、小脳、視床のシナプスとは対照的に、このシナプうでは生後発達に伴ってEPSCに対する -Aga-IVAの投与によりほぼ完全に抑制された。しかし、脳幹、小脳、視床のシナプスとは対照的に、このシナプうでは生後発達に伴ってEPSCに対する -CgTxの抑制効果が、少なくとも生後40日までは変化しなかった。 -CgTxの抑制効果が、少なくとも生後40日までは変化しなかった。 同様の傾向は脊髄のグリシン作動性抑制性シナプスにおいても認められた。厚さ250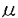 mの脊髄の水平断スライスを作製し、脊髄後角第II層の神経細胞よりホールセル記録を行い、近傍の介在ニューロンを刺激してグリシン作動性IPSCを誘発した。脊髄後角のIPSCは生後54日目においても生後1週目、生後4週目のラットと同様に mの脊髄の水平断スライスを作製し、脊髄後角第II層の神経細胞よりホールセル記録を行い、近傍の介在ニューロンを刺激してグリシン作動性IPSCを誘発した。脊髄後角のIPSCは生後54日目においても生後1週目、生後4週目のラットと同様に -CgTxにより約40%抑制された。 -CgTxにより約40%抑制された。 これらの実験結果から、哺乳類の中枢神経系におけるシナプス伝達には生後早期にはこれまで考えられていたようにN型とP/Q型両方のCa2+チャネルによって媒介されるが、生後発達に伴いN型Ca2+チャネルがP/Q型に置換されるシナプスと、生後発達とは無関係にN型Ca2+チャネルが神経伝達に関与し続けるシナプスに分化されることがわかった。シナプス前末端のCa2+チャネルの変化は、生後発達に伴う伝達物質の放出効率の変化やG蛋白を介するシナプス前抑制の変化に影響を与えるものと考えられる。 |