| 内容要旨 | | 序章時間分解蛍光測定法(TRF)の検出原理 HTSの蛍光検出において,自家蛍光等のbackground蛍光を減らすことは重要な課題である.通常の有機化合物は蛍光の寿命が短く,数nから数十n秒であるのに対しランタノイド錯体の蛍光は数十 から数m秒と非常に長寿命である.パルス励起光照射後,delay timeを設けて蛍光測定を行えば,夾雑する蛍光の妨害を除くことができ長寿命蛍光だけを特異的に検出できる.TRFはHTSの問題点を解決しうる検出法である. から数m秒と非常に長寿命である.パルス励起光照射後,delay timeを設けて蛍光測定を行えば,夾雑する蛍光の妨害を除くことができ長寿命蛍光だけを特異的に検出できる.TRFはHTSの問題点を解決しうる検出法である. Fluorescence Resonance Energy Transfer(FRET) FRETは一つの測定系にドナーとアクセプターがある時,ドナーを励起した際に,アクセプターの蛍光が観察される現象である.励起状態のドナーがアクセプターを励起するFRETの速度定数kTは,フェルスターの定理に従う.本定理によるとkTはドナーの蛍光スペクトルとアクセプターの吸収スペクトルの重なりの大きさ,すなわち重なり積分Jに比例して増大する. 合成小分子によるFRET-TRFシステム 本研究で開発した合成小分子によるFRET-TRFシステムをFig.1に示す.FRETのドナーにランタノイド錯体を用い,アクセプターには最初は無蛍光で,生体内分子との反応により蛍光性分子に化学変換される合成小分子を選択する.本システムでは,ランタノイド錯体からのFRETにより生じるアクセプターの長寿命蛍光をTRFで検出する.すなわち,標的とする生体内分子に対する特異性をアクセプターに持たせ,ランタノイド錯体からのFRETにより生じるアクセプターの長寿命蛍光シグナルをTRFを用いて検出する.検出されるシグナルは長寿命であるので,より特異的な検出が可能となる.また,本システムでは様々な生体内分子に対応したアクセプターをデザイン,合成することで様々な生体内分子を時間分解蛍光測定法で特異的に検出できると考えた. 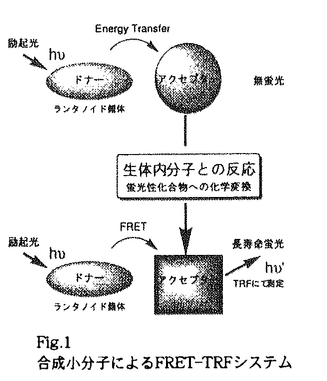 Fig.1 合成小分子によるFRET-TRFシステム第1章Eu3+錯体対応新規長波長励起蛍光物質の開発 Fig.1 合成小分子によるFRET-TRFシステム第1章Eu3+錯体対応新規長波長励起蛍光物質の開発 Eu3+錯体の蛍光波長はキレーターの違いに無関係であり,いずれも5D0→7F2の遷移に伴う615nmのシャープなピークを有する.以下の3つの条件を満たし,この波長により励起されるアクセプター分子のデザイン,合成を行った:(1)安定であり,化学修飾が容易である(2)蛍光団の電子状態の変化により蛍光量子収率が変化しうる(3)水中で蛍光を有する.種々の化合物について検討した結果,Fig.2に示すSNR3がEu3+錯体の蛍光のアクセプターとして最適であることが判明した.  Fig.2 新規長波長励起蛍光物質第2章FRETのアクセプターとしてのSNR3の蛍光特性の検討分子内FRETに関する検討 Fig.2 新規長波長励起蛍光物質第2章FRETのアクセプターとしてのSNR3の蛍光特性の検討分子内FRETに関する検討 FRETにより生じるアクセプターの蛍光を検出する目的で,ドナーに有機性蛍光物質を用い,様々なリンカーを介してSNR3と結合させた化合物を検討した.その結果,ドナーとアクセプターを立体障害が大きなステロイド骨格をリンカーに取り入れた化合物で,ドナーを励起した際にRET由来で生じるSNR3の蛍光が検出された.FRETを起こすには強固な骨格を有するリンカーが必要であること,及びSNR3がFRETのアクセプターとして用いることができることが判明した. 第3章SNR3の長寿命蛍光検出系の開発 蛍光性ランタノイド錯体とSNR3を同一分子内に有する,Fig.3に示す化合物(1)及び(2)をデザイン合成し,時間分解蛍光測定を行った.その結果,両化合物とも無蛍光となった.  Fig.3 Eu3+錯体とSNR3をリンカーを介して結合させた分子 Fig.3 Eu3+錯体とSNR3をリンカーを介して結合させた分子 化合物(1)はドナーとアクセプターが分子内で会合することにより,また化合物(2)はFRETの速度定数が大きすぎることによるものと考えられる. 化合物(2)の分子内エステル結合切断前後での時間分解蛍光スペクトルの変化をFig.4に示す.Fig.4より,切断後には,Eu3+錯体以外の蛍光が生じることが分かる.この新たに生じた蛍光について,Eu3+錯体からのFRETにより生じたSNR3の蛍光であると予測した.そこで,分子間FRETに関する検討を行った.その結果Eu3+錯体から5-CSNR3へ分子間でFRETが起きることが明らかになった.  Fig.4 化合物(2)のエステル切断前後での時間分解蛍光スペクトルの変化 Fig.4 化合物(2)のエステル切断前後での時間分解蛍光スペクトルの変化 以上,SNR3の長寿命蛍光検出系として,Eu3+錯体+5-CSNR3共存系を見いだした. 第4章合成小分子によるFRET-TRFシステムの開発 生体内分子検出系に応用するには,アクセプターの化学変換に伴う長寿命蛍光のスイッチングが不可欠である.アクセプターの化学変換に伴う量子収率の変化を共存系を用いてTRFで検出することとした.アクセプターの量子収率に変化を及ぼす化学変換のモデルにアセチル化を選択しFig.5に示すAminoSNR3及びAmideSNR3を用いて検討した.  Fig.5 共存系に用いたSNR3誘導体 Fig.5 共存系に用いたSNR3誘導体 AminoSNR3共存系ではエネルギー移動は生じるものの,AminoSNR3は無蛍光であるため,655nmの蛍光は増大しなかった.一方,Amide SNR3共存系ではEu3+錯体からのFRETにより生じるAmideSNR3の655nmの蛍光が観測された.これらの結果はアクセプターの量子収率の変化をEu3+錯体+SNR3誘導体共存系により,TRFで検出できたことを示している. 以上,合成小分子によるFRET-TRFシステム(Fig.1)の開発に成功した.本システムを用いれば,多様な生体内分子を簡便にTRFで検出でき,HTSにおけるbackground蛍光についての問題点を解決できると考えられる. 第5章FRET-TRFによる生体内分子NO検出系の開発 開発したFRET-TRFを生体内分子検出に応用する際の問題点として,一般にEu3+錯体の蛍光強度は水中で弱いことが考えられる.蛍光性Tb3+錯体,Tb3+DTPAcs124は同じEu3+錯体のおよそ20倍の蛍光強度を有することが知られている.本Tb3+錯体をドナーに用いれば,ドナーにEu3+錯体を用いたときと比較して感度の上昇が期待できる.そこで本Tb3+錯体をドナーに用いることとした.アクセプターには当研究室で開発したNO感受性蛍光色素DAR-Mを用い,FRET-TRFによるNO検出系を確立した.FRET-TRFによるNO検出系の概念図をFig.6に示す.  Fig.6 DAR-M,DAR-MTによるFRET-TRFを用いたNOアッセイ系の概念図 Fig.6 DAR-M,DAR-MTによるFRET-TRFを用いたNOアッセイ系の概念図 蛍光性Tb3+錯体の蛍光スペクトルには5D4→7F5の遷移に伴う545nmのシャープなピークがあり,スペクトルの形は錯体の種類によらず一定である. DAR-MはNOとの反応によりトリアゾール体DAR-MTを生成し,蛍光量子収率が増大する.DAR-MTは545nmで励起され584nmの蛍光を出す.Tb3+錯体とDAR-Mの共存系においてNOが生成すれば,Tb3+錯体からのFRETにより生じるDAR-MTの長寿命蛍光をTRFで検出できると考えた. Tb3+錯体+DAR-M,DAR-MT共存系の時間分解蛍光測定 Tb3+錯体+DAR-M,DAR-MT共存系の時間分解蛍光スペクトル及びTb3+錯体由来の545nmと,DAR-MT由来の584nmの各波長での蛍光寿命を検討した.DAR-M共存系ではTb3+錯体由来の蛍光強度,蛍光寿命共に減少した.これは,Tb3+錯体からDAR-Mへのエネルギー移動が生じていることを示している.励起エネルギー移動が生じても,DAR-Mは無蛍光であるので584nmの蛍光は増大しない. 一方DAR-MT共存系では,Tb3+錯体由来の蛍光が減少するだけでなく新たにDAR-MT由来の584nmの蛍光が生じた.この時545nmと584nmの蛍光寿命が 秒オーダーの値で一致しながら,DAR-MT濃度依存的に減少した.これは,新たに生じた584nmの蛍光が,Tb3+錯体からのFRETにより生じたDAR-MTの長寿命蛍光であることを示している.以上,FRETのドナーにTb3+錯体を,アクセプターにDAR-Mを用いた共存系における584nmの蛍光の伸びを観測すれば,NO産生をTRFで検出できることを示した. 秒オーダーの値で一致しながら,DAR-MT濃度依存的に減少した.これは,新たに生じた584nmの蛍光が,Tb3+錯体からのFRETにより生じたDAR-MTの長寿命蛍光であることを示している.以上,FRETのドナーにTb3+錯体を,アクセプターにDAR-Mを用いた共存系における584nmの蛍光の伸びを観測すれば,NO産生をTRFで検出できることを示した. Tb3+錯体+DAR-M共存系を用いたFRETによるNO生成の検出 FRETによりNO生成を検出するため,10 MTb3+錯体と,3 MTb3+錯体と,3 MDAR-MをpH7.0のリン酸buffer中で共存させた.ここに,NOC13を加えた.その時の584nmの相対蛍光強度の経時変化をFig.7に示す.尚,本スペクトルは時間分解ではなく通常の蛍光強度変化ではあるが,時間分解蛍光測定をすれば同様の結果になると考えられる. MDAR-MをpH7.0のリン酸buffer中で共存させた.ここに,NOC13を加えた.その時の584nmの相対蛍光強度の経時変化をFig.7に示す.尚,本スペクトルは時間分解ではなく通常の蛍光強度変化ではあるが,時間分解蛍光測定をすれば同様の結果になると考えられる. 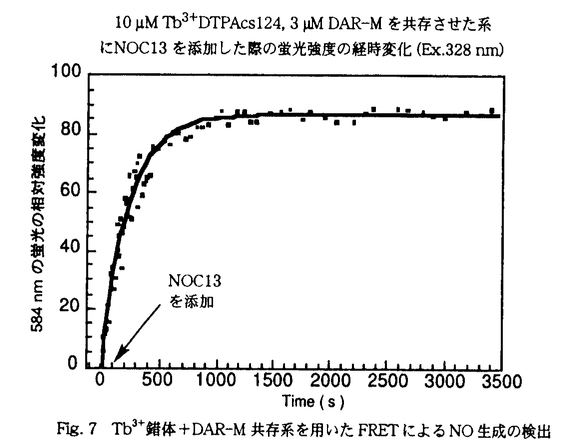 Fig.7 Tb3+錯体+DAR-M共存系を用いたFRETによるNO生成の検出 Fig.7 Tb3+錯体+DAR-M共存系を用いたFRETによるNO生成の検出 584nmの蛍光強度がNO生成と共に増大した.時間分解蛍光スペクトル,蛍光寿命の検討よりこの変化は,Tb3+錯体からDAR-MTへのFRETによりNO生成を検出している.本系を応用すれば,HTSでの蛍光プレートリーダーを用いたNO産生測定がTRFで可能となり,NO合成酵素誘導薬や阻害剤のアッセイ系等に応用できる. 総括 本研究で明らかにしたことを以下に記す Eu3+錯体対応型新規長波長励起蛍光物質SNR3を開発した. 合成小分子によるFRET-TRFシステムを開発した. FRET-TRFによるNO検出系の開発として,当研究室で開発したNO感受性蛍光色素DAR-M,DAR-MTを用い,FRET-TRFによるNO検出系を確立した.将来的には,加水分解酵素,Ca2+,Zn2+等様々な生体内分子のアッセイ系をFRET-TRFを用いて簡便に構築できると考えられる. |