| 1)研究の背景及び目的 Dysidiolide(1)は1996年、アメリカのハーバーブランチ海洋研究所のGunasekeraらとコーネル大学のClardyらのグループにより、カリブ海産海綿Dysidea etheria de Laubenfelsから単離、構造決定された新規セスタテルペンで、細胞周期のG1-S期の進行を促進するリン酸化酵素cdk2-cyclinE complexを活性化する脱リン酸化酵素cdc25Aの特異的阻害剤として報告された初の天然物である。Dysidiolideはわずかにしか発見されていないセスタテルペン類の中でも複雑かつ希少なビシクロ環状構造をしており、合成標的として興味深い。特にそのoctalin環の構築や環上の各種不斉点の立体制御、更に4位水酸基の立体選択的な導入などは有機合成化学的にチャレンジングであり、現在までに海外の三組のグループがDysidiolideの全合成を報告している。しかしそれらの研究は構造合成に終始しており、活性発現に必須な構造因子の探索を始めとする構造活性相関への展開は為されていない。更に活性面においてもcdc25Aによるin vitroでのp-nitrophenyl phosphateの脱リン酸化阻害活性(IC50=9.4 M)が確認されたのみで、細胞レベルでのbiologicalな性質については未解明である。そこで著者は精密有機合成化学の方法論及びテクノロジーを駆使して合成標的としてチャレンジングなDysidiolideを不斉全合成することに加え、合理的かつ効率的な構造変換に基づいた構造活性相関研究を遂行するとともに、合成したDysidiolideを用いて、未解明であるそのbiologicalな性質について検討することを目的とした。 M)が確認されたのみで、細胞レベルでのbiologicalな性質については未解明である。そこで著者は精密有機合成化学の方法論及びテクノロジーを駆使して合成標的としてチャレンジングなDysidiolideを不斉全合成することに加え、合理的かつ効率的な構造変換に基づいた構造活性相関研究を遂行するとともに、合成したDysidiolideを用いて、未解明であるそのbiologicalな性質について検討することを目的とした。  2)構造変換の基本戦略(Figure 1) Dysidiolideの構造から -hydroxybutenolideはcdc25A活性部位に不可逆的な阻害を与える活性中心であり、アルケニル側鎖は酵素に存在すると推測した疎水性領域との相互作用に関与する部位であると推定した。そこで構造変換の中心に考えたのが、それら両重要部位の中心に位置する6位四級炭素である。6位四級炭素の立体配置の変換やメチル基の有無により両側鎖の空間的な相対位置関係に変化が生じて活性に大きな影響を及ぼすことが予想される。更に想定した活性サイト近傍に位置する4位水酸基の機能については触媒領域中の極性アミノ酸残基との相互作用等が推測され、絶対配置の変換は活性に大きな影響を及ぼすと考えた。変換を目的とした4位、6位以外の部分の立体配置は確実に制御すべく、反応の選択性を使い分けた合成ルートを設計することにした。 -hydroxybutenolideはcdc25A活性部位に不可逆的な阻害を与える活性中心であり、アルケニル側鎖は酵素に存在すると推測した疎水性領域との相互作用に関与する部位であると推定した。そこで構造変換の中心に考えたのが、それら両重要部位の中心に位置する6位四級炭素である。6位四級炭素の立体配置の変換やメチル基の有無により両側鎖の空間的な相対位置関係に変化が生じて活性に大きな影響を及ぼすことが予想される。更に想定した活性サイト近傍に位置する4位水酸基の機能については触媒領域中の極性アミノ酸残基との相互作用等が推測され、絶対配置の変換は活性に大きな影響を及ぼすと考えた。変換を目的とした4位、6位以外の部分の立体配置は確実に制御すべく、反応の選択性を使い分けた合成ルートを設計することにした。  Figure 1.構造変換の基本戦略3)Dysidiolideの逆合成解析(Scheme 1) Figure 1.構造変換の基本戦略3)Dysidiolideの逆合成解析(Scheme 1) 天然体及び前述の基本戦略に基づく構造変換類縁体合成に柔軟に対応出来る合成ルートを開発すべく、Dysidiolideを基本化合物として逆合成解析を行った。 -hydroxybutenolide部位は3-furyllithiumのaldehyde(2)へのl,2-付加後、一重項酸素酸化反応での構築を考えた。1,2-付加では4位エピ体も得たいので不斉源は用いない。6位四級炭素は天然体の -hydroxybutenolide部位は3-furyllithiumのaldehyde(2)へのl,2-付加後、一重項酸素酸化反応での構築を考えた。1,2-付加では4位エピ体も得たいので不斉源は用いない。6位四級炭素は天然体の 配置と 配置と 配置を作り分けるべく、3の塩基処理で生成するexocyclic enolateのメチル化で導入し、octalin骨格はLewis酸存在下、crotonaldehydeと光学活性なtriene(4)との分子間Diels-Alder反応で構築する経路を考えた。 配置を作り分けるべく、3の塩基処理で生成するexocyclic enolateのメチル化で導入し、octalin骨格はLewis酸存在下、crotonaldehydeと光学活性なtriene(4)との分子間Diels-Alder反応で構築する経路を考えた。 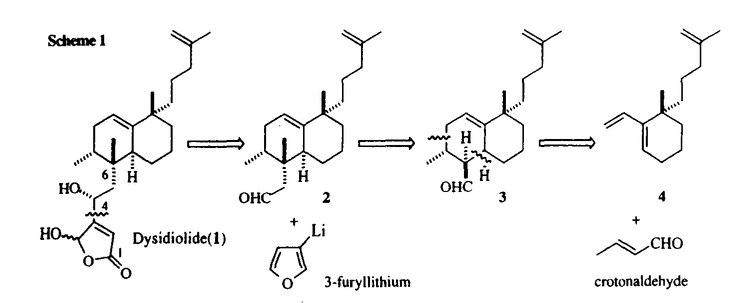 Scheme 14)光学活性triene(4)の合成(Scheme 2) Scheme 14)光学活性triene(4)の合成(Scheme 2) 出発原料となるketoester(5)はd’Angeloらの方法に従い3工程で合成した。常法に従い、iodide(7)に誘導後,cuprateとのクロスカップリングによりalkenyl側鎖を構築した。次に無水CeCl3存在下、臭化vinylmagnesiumでvinylcarbinolに誘導し、続く無水CuSO4での脱水反応により光学活性triene(4)を得た。  Scheme 25)天然体Dysidiolide(1)の全合成及び4-epi-Dysidiolide(13)の合成(Scheme 3-1 & 3-2) Scheme 25)天然体Dysidiolide(1)の全合成及び4-epi-Dysidiolide(13)の合成(Scheme 3-1 & 3-2) Lewis酸存在下、crotonaldehydeとtriene(4)との分子間Diels-Alder反応により目的のendo体(3)を含むendo、exo-付加体の混合物を得た。この混合物をAlH3で還元し、容易に分離可能なalcoholへと誘導し、目的のalcohol体(9)を得た。TPAPで再酸化して3へと変換後、t-BuOK処理で生じたexocyclic enolateとCH3Iとの反応でmethyl基を導入した。この際、 面からのアルキル化が優先し天然体とは逆配置のepi-10が主に生成した。混合物をalcoholへ誘導して分離することにより、天然体及び6位四級炭素が逆配置の類縁体の合成に必要な重要中間体である11とepi-11をそれぞれ純粋な形で確保出来た。次いで11に増炭反応を施しaldehyde(2)へと変換した。2への3-furyllithiumの1,2-付加後、4-epi-12を分離して12を得、更に一重項酸素酸化反応によりDysidiolide(1)の不斉全合成を完了した。その各種スペクトル及び分析データは報告されている天然物のものと一致した。尚4-epi-12にも同様に一重項酸素酸化反応を行い、目的の4-epi-Dysidiolide(13)を得た。 面からのアルキル化が優先し天然体とは逆配置のepi-10が主に生成した。混合物をalcoholへ誘導して分離することにより、天然体及び6位四級炭素が逆配置の類縁体の合成に必要な重要中間体である11とepi-11をそれぞれ純粋な形で確保出来た。次いで11に増炭反応を施しaldehyde(2)へと変換した。2への3-furyllithiumの1,2-付加後、4-epi-12を分離して12を得、更に一重項酸素酸化反応によりDysidiolide(1)の不斉全合成を完了した。その各種スペクトル及び分析データは報告されている天然物のものと一致した。尚4-epi-12にも同様に一重項酸素酸化反応を行い、目的の4-epi-Dysidiolide(13)を得た。 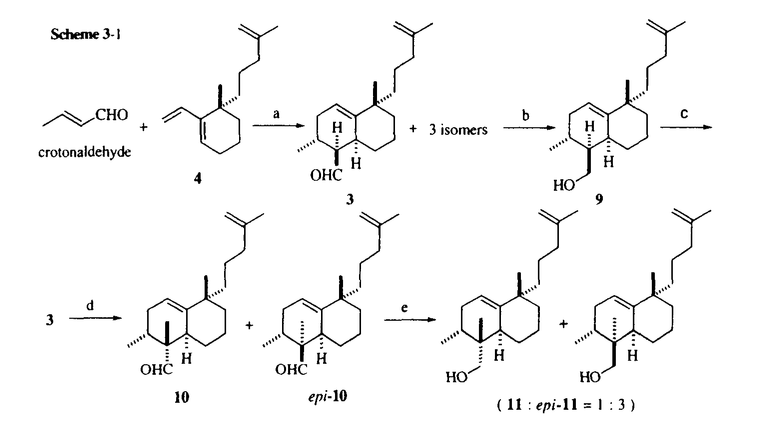 Scheme 3-1 Scheme 3-1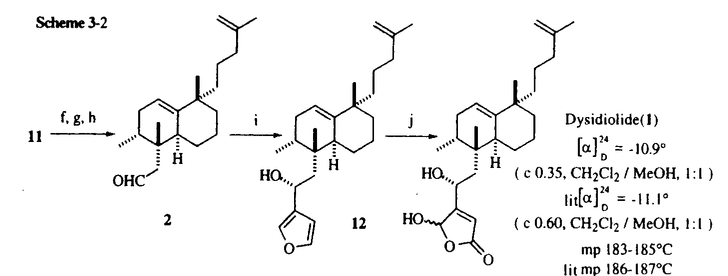 Scheme 3-26)構造変換類縁体の合成及び活性評価(Figure 2) Scheme 3-26)構造変換類縁体の合成及び活性評価(Figure 2) 目的の4位及び6位の構造変換類縁体を合成し、天然体も含めて酵素阻害活性及びSBC-5(ヒト肺癌細胞)増殖抑制活性を評価した。14はepi-11、6-desmethyl-14(15)は9から天然体Dysidiolideの合成法に基づき合成した。14、15の4位水酸基の絶対配置は新Mosher法にて決定した。一方14、15の4位エピ体は何れもフラン前駆体の段階で分解が進行したために得られなかった。  Figure 2 Figure 2 Dysidiolideはcdc25Aのisoformであるcdc25Bに微弱な活性を示し,cdc25A特異的阻害性を示唆する結果となった。別途合成した単環類縁体(16)が何れの酵素にも阻害活性を示さなかったことから、アルケニル側鎖または二環構造は活性に必須であり、これらの部分構造は当初推定した酵素の疎水性領域との相互作用に関与すると考えられる。4位、6位構造変換類縁体は何れも天然体を上回る酵素阻害活性を示し、更に14は天然体を凌ぐ強い抗腫瘍活性を示した。4位水酸基の絶対配置は主に酵素特異性に関与していると考えられる。6位の立体配置や構造の変化で -hydroxybutenolide側鎖とアルケニル側鎖の空間的な相対位置関係が変化しているはずであるにも関わらず、類縁体が何れも天然体を凌ぐ酵素阻害活性を示したことは、両側鎖がかなりの自由度を持って酵素に結合することを窺わせる結果と言える。また天然体の持つ立体配置は主に酵素特異性に寄与していることが示唆された。 -hydroxybutenolide側鎖とアルケニル側鎖の空間的な相対位置関係が変化しているはずであるにも関わらず、類縁体が何れも天然体を凌ぐ酵素阻害活性を示したことは、両側鎖がかなりの自由度を持って酵素に結合することを窺わせる結果と言える。また天然体の持つ立体配置は主に酵素特異性に寄与していることが示唆された。 7)Dysidiolideのbiologicalな性質の検討7-1FACSによる細胞周期解析 Dysidiolideが腫瘍細胞の細胞周期に及ぼす影響をFACS(fluorescence activated cell sorting)を用いた細胞周期解析により調査した。SBC-5(ヒト肺癌細胞)をDysidiolide共存下でインキュベートした後、DNAを蛍光染色し、FACSにて解析した。そのヒストグラムをFigure3に示す。  Figure 3.FACSによる細胞周期阻害点の解析 Figure 3.FACSによる細胞周期阻害点の解析 横軸に蛍光強度、即ちDNA含量を示し、縦軸に各強度の細胞数をプロットすることでDNA含量の分布がわかる。G1期の細胞は一倍体、分裂期であるG2/M期の細胞は倍数体のため通常はcontrolの様な分布になる。解析の結果、Dysidiolide処理すると倍数体であるG2/M期の細胞が消失し、G1期細胞が集積した。これはDysidiolideが腫瘍細胞の細胞周期をG1期で停止させていることを示している。 7-2Dysidiolideのcdk2脱リン酸化阻害活性 続いてDysidiolideがcdc25Aの細胞内基質であるcdk2の脱リン酸化を阻害するか検証した。SBC-5(ヒト肺癌細胞)をDysidiolide共存下でインキュベートした後、細胞内蛋白についてcdk2抗体を用いたWestern blottingを行った(Figure 4)。  Figure 4.Dysidiolideのcdk2脱リン酸化阻害活性 Figure 4.Dysidiolideのcdk2脱リン酸化阻害活性 上のバンドはリン酸化を受けたcdk2、下のバンドは細胞内で脱リン酸化されて生成したcdk2である。この結果からDysidiolide処理した細胞では濃度依存的にcdk2の脱リン酸化が抑えられており、Dysidiolideが細胞レベルでcdc25Aによる脱リン酸化を阻害することが明らかになった。 8)まとめ 本研究では天然体Dysidiolide(1)並びに構造変換類縁体(13〜15)の効率的合成ルートを開発し、活性発現や酵素特異性に必須な構造因子の解明に大きく寄与する重要な知見を得、更には天然体を上回るcdc25A阻害活性を示す類縁体の創製にも成功した。また合成したDysidiolideを用いて、未知であった細胞レベルでのbiologicalな性質を解明した。今後はこれらの有力な情報を基に構造最適化を図り、より機能的に優れたcdc25A阻害剤の創製を検討したいと思う。 |