結果と考察1.IL-1によるNF B、JNK活性化におけるTRAF6の役割
B、JNK活性化におけるTRAF6の役割 まず、二つあるTRAF6の遺伝子座のうち一方が除かれているヘテロマウスを交配させ、14.5日胚を得た。これら胎児のTRAF6遺伝子を解析し、野生型およびTRAF6ノックアウトマウス胎児より不死化線維芽細胞株を樹立した。これら細胞株のTRAF6の発現をタンパク質レベルで解析し、TRAF6ノックアウトマウス由来の線維芽細胞株にTRAF6の発現がないことを確認した。
つぎにこれら細胞株を用い、IL-1によるNF B、AP-1の活性化にTRAF6がどのような役割を持つか解析した(Fig.1)。なお、AP-1についてはその上流因子c-Jun N-terminal kinase(JNK)の活性化を測定し、AP-1の活性化とした。その結果、野生型細胞株ではIL-1によって誘導されるNF
B、AP-1の活性化にTRAF6がどのような役割を持つか解析した(Fig.1)。なお、AP-1についてはその上流因子c-Jun N-terminal kinase(JNK)の活性化を測定し、AP-1の活性化とした。その結果、野生型細胞株ではIL-1によって誘導されるNF BおよびJNKの活性化がTRAF6欠損細胞株では確認されなかった。これがTRAF6が欠損していること以外に原因があるか確認するため、TRAF6欠損細胞株へ野生型TRAF6を導入した細胞株を樹立しIL-1処理を行ったところ、NF
BおよびJNKの活性化がTRAF6欠損細胞株では確認されなかった。これがTRAF6が欠損していること以外に原因があるか確認するため、TRAF6欠損細胞株へ野生型TRAF6を導入した細胞株を樹立しIL-1処理を行ったところ、NF B及びJNKの活性化は回復した。これらの結果よりTRAF6はIL-1シグナルによるNF
B及びJNKの活性化は回復した。これらの結果よりTRAF6はIL-1シグナルによるNF B、JNKの活性化に必須なタンパク質であることが証明された。
B、JNKの活性化に必須なタンパク質であることが証明された。
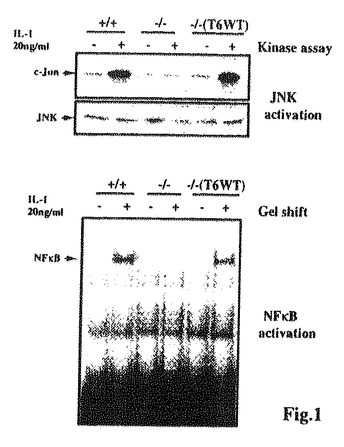 Fig.12.NF
Fig.12.NF B、JNK活性化に必要なTRAF6機能ドメインの解析
B、JNK活性化に必要なTRAF6機能ドメインの解析 IL-1を介したシグナルは、そのシグナル上のある点でNF B活性化、JNK活性化の二つのシグナルに分岐する。TRAF6はNF
B活性化、JNK活性化の二つのシグナルに分岐する。TRAF6はNF B、JNKのどちらの活性化にも必要なタンパク質であることが示されたので、このシグナルの分岐点である可能性がある。分岐点の役割をTRAF6が持つ場合、NF
B、JNKのどちらの活性化にも必要なタンパク質であることが示されたので、このシグナルの分岐点である可能性がある。分岐点の役割をTRAF6が持つ場合、NF B、JNK活性化を担う機能ドメインが異なると考えられる。TRAF6はFig.2に示す構造を持ちアミノ末端側のRING fingerおよび5つ並んだZinc fingerドメインが下流へのシグナル伝達に必要と考えられている。そこでアミノ末端側から順に除く一連の欠損変異体を作成し(Fig.2-A)、これをTRAF6欠損細胞株へ導入して解析を行った。なお、これらTRAF6変異体は遺伝子導入の際に野生型細胞株の内在性TRAF6の発現量とほぼ等しくなるよう調整した。
B、JNK活性化を担う機能ドメインが異なると考えられる。TRAF6はFig.2に示す構造を持ちアミノ末端側のRING fingerおよび5つ並んだZinc fingerドメインが下流へのシグナル伝達に必要と考えられている。そこでアミノ末端側から順に除く一連の欠損変異体を作成し(Fig.2-A)、これをTRAF6欠損細胞株へ導入して解析を行った。なお、これらTRAF6変異体は遺伝子導入の際に野生型細胞株の内在性TRAF6の発現量とほぼ等しくなるよう調整した。
その結果、RING fingerドメインを除くとJNKの活性化が半減した(Fig.2-B)。さらにZinc fingerドメインを順に除くとそれに比例し活性が減少し、Zinc fingerドメインをすべて除いた変異体T6 RZ5においてはその活性化は認められなくなった。これらの結果よりJNKの活性化はRING fingerおよびZinc fingerドメインに依存していると考えられる。
RZ5においてはその活性化は認められなくなった。これらの結果よりJNKの活性化はRING fingerおよびZinc fingerドメインに依存していると考えられる。
これに対し、NF Bの活性化はZinc fingerドメインを3つまで除いた変異体T6
Bの活性化はZinc fingerドメインを3つまで除いた変異体T6 RZ3までは特に活性化に変化は認められなかった(Fig.2-C)。しかし、4番目、5番目のZinc fingerドメインを除いた結果、活性化は大きく減少した。このことより4番目、5番目のZinc fingerドメインはNF
RZ3までは特に活性化に変化は認められなかった(Fig.2-C)。しかし、4番目、5番目のZinc fingerドメインを除いた結果、活性化は大きく減少した。このことより4番目、5番目のZinc fingerドメインはNF Bの活性化に大きな役割を持つと考えられる。さらにこれまでNF
Bの活性化に大きな役割を持つと考えられる。さらにこれまでNF B活性化能はなくドミナントネガティブ変異体であると考えられていた変異体T6
B活性化能はなくドミナントネガティブ変異体であると考えられていた変異体T6 RZ5にもNF
RZ5にもNF B活性化能が存在することが明らかになった。
B活性化能が存在することが明らかになった。
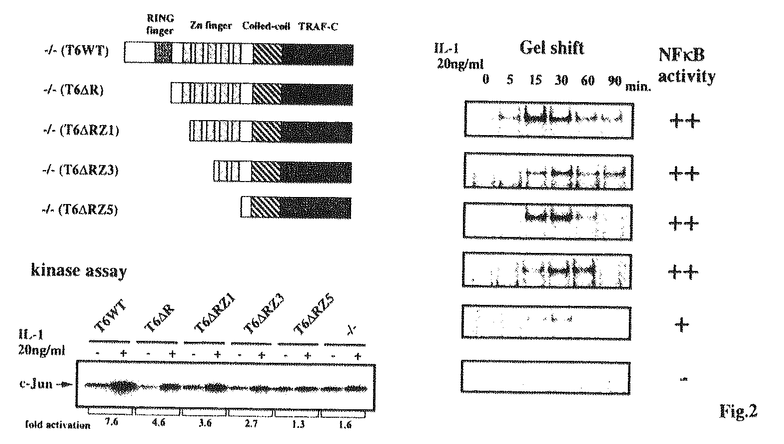 Fig.2
Fig.2 これらの結果よりTRAF6におけるJNK、NF B活性化を担当する機能ドメインは異なることが示され、IL-1シグナルはTRAF6において分岐することが明らかになった。
B活性化を担当する機能ドメインは異なることが示され、IL-1シグナルはTRAF6において分岐することが明らかになった。
3.TRAF6によるTGF- activated kinase 1(TAK1)の活性化
activated kinase 1(TAK1)の活性化 TRAF6がIL-1シグナルにおける分岐点であることが示されたので、続いてTRAF6により直接活性化される分子として候補に挙げられているTAK1の活性化に対するTRAF6の各ドメインの役割について検討を行った(Fig.3)。TAK1はIL-1によって活性化し、かつIL-1シグナル依存的に内在性TRAF6と結合することが明らかにされている。そこで、まずTAK1の活性化にTRAF6が必要であるかTRAF6欠損細胞を用いて検討した。その結果、野生型細胞株で誘導されるIL-1によるTAK1の活性化が、TRAF6欠損細胞では認められないことが明らかになった。このTRAF6欠損細胞へTRAF6を発現させるとTAK1の活性化が回復することよりIL-1によるTAK1の活性化にTRAF6は必須であることが証明された。さらにTRAF6変異体を用いてTAK1の活性化に必要なドメインを検索したところ、RING fingerドメインを削るとTAK1活性化能が失われることが明らかになり、TAK1の活性化はTRAF6のRING fingerドメイン依存的であることが明らかになった。Fig.2に示したように、RING finger欠損によりJNKの活性化は半減するが、NF Bの活性化には大きな変化は認められない。したがって、IL-1シグナルにおいてTAK1は主にJNKの活性化シグナルに寄与している可能性が示された。さらに、TRAF6はTAK1以外の他の分子も介してJNK、NF
Bの活性化には大きな変化は認められない。したがって、IL-1シグナルにおいてTAK1は主にJNKの活性化シグナルに寄与している可能性が示された。さらに、TRAF6はTAK1以外の他の分子も介してJNK、NF Bの活性化を誘導していることが明らかになった。
Bの活性化を誘導していることが明らかになった。
 Fig.34.二量体形成によるTRAF6のシグナル伝達機構
Fig.34.二量体形成によるTRAF6のシグナル伝達機構 TRAF6がIL-1シグナルにおいて非常に重要な役割を持つことが明らかになったが、TRAF6は酵素活性が認められないことからどのようなメカニズムでシグナルを伝達しているか不明である。しかし、TRAF6は過剰発現により下流の分子を活性化させる、TRAF6同士が結合しうる、さらに同じTRAFタンパク質ファミリーのTRAF2は結晶構造中で三量体を形成するという点よりTRAF6は分子が集合する事によりシグナルを伝達すると考えられる。そこで、TRAF6の二量体形成がシグナル伝達のメカニズムであると考え次の実験を行った。
大腸菌の酵素の一つトポイソメラーゼのサブユニットgyrase Bはクマリンという化合物と非常に強い親和性を示す。そのため、gyrase Bとの融合タンパク質は、クマリン骨格を二つ持つ化合物coumermycinA1の添加により二量体形成が誘導される(Fig.4)。
 Fig.4
Fig.4 そこで、TRAF6同士の結合に必要なドメインであるTRAF-Cドメインをgyrase Bに置換した融合タンパク質T6RZC-GHを作成し、TRAF6欠損細胞に導入し恒常発現させた。この細胞株にcoumermycinA1を添加したところNF Bの活性化が誘導された。この活性化の強度、および時間経過は野生型細胞株にIL-1処理を行った時とほぼ一致している。JNKの活性化についても同様の現象が認められた。よってこの実験系は生理状態を反映していると考えられる。したがって、TRAF6は二量体形成によりシグナルを伝達しうることが明らかになった。
Bの活性化が誘導された。この活性化の強度、および時間経過は野生型細胞株にIL-1処理を行った時とほぼ一致している。JNKの活性化についても同様の現象が認められた。よってこの実験系は生理状態を反映していると考えられる。したがって、TRAF6は二量体形成によりシグナルを伝達しうることが明らかになった。