【序】Multidrug resistance associated protein(MRP)はP糖蛋白質同様、ATPの加水分解とカップルして基質を細胞内から能動的にくみ出す、ATP-binding cassette(ABC)transporter superfamilyに属し、これまでにMRP1から6までの6種類がクローニングされている。そのうち1から3の3種類に関してはその基質特異性が報告されており、MRP1、2はグルタチオン抱合体、グルクロン酸抱合体を共に良い基質とする一方、MRP3はグルタチオン抱合体は良い基質とせず、グルクロン酸抱合体を良い基質とする。しかしながら、これら両抱合体が、MRP1、或いは2分子上の共通の基質認識部位によって認識されているのか、また、どのようなアミノ酸配列の違いがMRP1/2とMRP3の基質認識性の差異を決定するのかに関する情報は皆無である。MRPファミリーの広範な基質認識メカニズムの解明は、内因性、外因性化合物のMrp2を介した薬物間相互作用の解析のみならず、MRPファミリー全体の基質認識/輸送部位の解明につながるものと考えられる。そこで私は基質に関する情報の最も多いラットMrp2をモデル蛋白として、その輸送活性に影響を及ぼすアミノ酸の同定を試みた。MRPファミリーの基質として少なくとも1つ以上のアニオンチャージを有すること、細胞内から細胞外への脂質二重層を経た輸送であることから、膜貫通ドメインに存在し、かつMRPファミリー間で保存されている電荷性アミノ酸が基質輸送過程に於いて重要であるとの仮説を考え、検討を進めることにした。 【方法】ヒト及びラットのMRP1〜3のalignmentより、膜貫通部位に存在する保存性電荷性性アミノ酸の検索を行った。Fig.1に示すようにMrp2は1541個のアミノ酸からなり、17回膜貫通ドメイン構造を有すると推察される。このうち膜貫通部位に47個のカチオン性アミノ酸が存在し、K308、K325、R586、R1019、R1201、R1226の6箇所はMRP1〜3全てで保存されていた。また、R1096、R1206の2箇所はMRP1、2にのみ存在した。これら保存性カチオンアミノ酸に、MRP1〜3全てで保存されているD329、E1208の2箇所のアニオン性アミノ酸、及びネガティブコントロールとしてMrp2にのみ存在するカチオン性アミノ酸K320の計11箇所のアミノ酸をそれぞれ中性アミノ酸に置換し、昆虫細胞Sf9細胞に発現させた。得られた細胞より膜ベシクルを調製し、基質認識性に及ぼす影響を検証した。  Fig.1 Mrp2の模式図と変異導入部位 Fig.1 Mrp2の模式図と変異導入部位 【各種変異体における取り込み活性】これまでにMrp2の基質となることが示されている2,4-dinitrophenyl-S-glutathione(DNP-SG)、leukotriene C4(LTC4)、17 estradiol-17 estradiol-17 -D-glucuronide(E217 -D-glucuronide(E217 G)、E3040-glucuronide(E3040-glu)の取り込みをATP存在下、非存在下で測定した。その結果、Fig.2に示す様に、アニオン性アミノ酸の変異体E1208Q、及びカチオン性アミノ酸の変異体R1206Mでは、これら全ての化合物の取り込みが消失した一方、K325M(325番目のKをMに置換したもの)、D329E及びR586Lにおいては共にグルクロン酸抱合体であるE217 G)、E3040-glucuronide(E3040-glu)の取り込みをATP存在下、非存在下で測定した。その結果、Fig.2に示す様に、アニオン性アミノ酸の変異体E1208Q、及びカチオン性アミノ酸の変異体R1206Mでは、これら全ての化合物の取り込みが消失した一方、K325M(325番目のKをMに置換したもの)、D329E及びR586Lにおいては共にグルクロン酸抱合体であるE217 G,E3040-gluのATP依存的な取り込みはwild type(wt)に比較して変化は見られないものの、グルタチオン抱合体であるDNP-SG,LTC4の取り込みが著しく低下した。K325M、R586LにおいてはDNP-SGの輸送親和定数Km、及びDNP-SGのE217 G,E3040-gluのATP依存的な取り込みはwild type(wt)に比較して変化は見られないものの、グルタチオン抱合体であるDNP-SG,LTC4の取り込みが著しく低下した。K325M、R586LにおいてはDNP-SGの輸送親和定数Km、及びDNP-SGのE217 G取り込みに対する阻害定数IC50は共に変異体で上昇しており、一方E217 G取り込みに対する阻害定数IC50は共に変異体で上昇しており、一方E217 Gの輸送親和定数Km、及びE217 Gの輸送親和定数Km、及びE217 GのDNP-SG取り込みに対する阻害定数IC50は共に変異体で低下していた。このことからK325とR586がグルタチオン抱合体の認識/輸送に重要であり、かつグルクロン酸抱合体の親和性をも規定している可能性が示唆された(Table 1)。 GのDNP-SG取り込みに対する阻害定数IC50は共に変異体で低下していた。このことからK325とR586がグルタチオン抱合体の認識/輸送に重要であり、かつグルクロン酸抱合体の親和性をも規定している可能性が示唆された(Table 1)。  Fig.2 Fig.2 Table 1.K325M、R586Lにおけるグルタチオン抱合体、グルクロン酸抱合体の輸送親和性、及び相互阻害親和性 Table 1.K325M、R586Lにおけるグルタチオン抱合体、グルクロン酸抱合体の輸送親和性、及び相互阻害親和性 【K325、D329、R586のグルタチオン抱合体認識に及ぼす影響】グルタチオン抱合体の輸送に重要と考えられたK325、D329、R586に対し、チャージを保持したまま、アミノ酸をそれぞれK→R、D→E、R→Kに置換した変異体、K325R、D329E、R586Kを作製し、基質認識性に及ぼすチャージの影響を検証した。その結果、Table 2に示すようにK325R、D329E共にグルタチオン抱合体に対する輸送能は低下したままなのに対し、R586Kではグルタチオン抱合体の輸送はwtと同程度まで回復した。このことから、325番目のK、329番目のDは少なくともそれぞれRとEのカチオン、アニオンチャージでは相補できないこと、及び586番目のRはKで相補できることが示された。  Table 2.グルタチオン抱合体輸送に関するMrp2の325、329、586番目のアミノ酸の相補性 Table 2.グルタチオン抱合体輸送に関するMrp2の325、329、586番目のアミノ酸の相補性 【グルタチオン構造の認識性】Gly,Cys,Gluのトリペプチドからなるグルタチオンのどの部分がMrp2の基質認識に必須なのかをwt、K325M、R586Lを用いて解析を試みた。モデル化合物としてグルタチオンの部分のみが異なり、かつMrp2の基質となることが示されているLTC4、LTD4、LTE4、LTF4を用い、E217 G取り込みへの阻害定数を求めた。その結果、table 3に示すようにLTC4でのみK325M、R586Lで阻害親和性がそれぞれ低下していることから、incactなグルタチオン構造がK325、R586の部分で認識されていることが示唆された。 G取り込みへの阻害定数を求めた。その結果、table 3に示すようにLTC4でのみK325M、R586Lで阻害親和性がそれぞれ低下していることから、incactなグルタチオン構造がK325、R586の部分で認識されていることが示唆された。  Table 3 E217 Table 3 E217 G輸送に対するロイコトリエン類の阻害定数(IC50( G輸送に対するロイコトリエン類の阻害定数(IC50(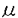 M)) M)) 【R1096変異体での胆汁酸輸送能付与】R1096Lではグルクロン酸抱合体、グルタチオン抱合体の輸送はwtと変わらないものの、MRP1、Mrp2が本来基質としない胆汁酸のタウロコール酸(TC)を基質とすることが明らかとなった(Fig.3)。Mrp3ではMRP1、Mrp2の1096番目のアミノ酸K、Rに対応するアミノ酸は1084番目の中性アミノ酸Lであることから、この部分のアミノ酸が胆汁酸の輸送能を規定している可能性が考えられた。しかしR1096M及びR1096Kにおいても胆汁酸の輸送能が認められたことから(Fig.3)、胆汁酸輸送は必ずしもこの部分のチャージの有無のみによって決定されているのでは無いと考えられた。Mrp3においてもこの部分のアミノ酸がMrp3における胆汁酸輸送能への関与を検証する目的で、rat Mrp3の1084番目のアミノ酸をLからカチオン性のアミノ酸K(L1084KMrp3)、R(L1084RMrp3)、及び中性を保持したままV(L1084VMrp3)、M(L1084MMrp3)に置換した変異体を作製した。このうちL1084MMrp3、L1084VMrp3ではE217 Gに対するTCの輸送能に変化は見られず、一方L1084KMrp3では両基質の取り込みが消失した(Fig.3)。L1084RMrp3においては分解物と思われる分子量が約半分の80kD付近にのみwestern blot上でバンドが認められ、E217 Gに対するTCの輸送能に変化は見られず、一方L1084KMrp3では両基質の取り込みが消失した(Fig.3)。L1084RMrp3においては分解物と思われる分子量が約半分の80kD付近にのみwestern blot上でバンドが認められ、E217 G、TCの輸送共に認められなかった。このことより、Mrp3においては1084番目のアミノ酸は必ずしもMrp2で見られたように胆汁酸の輸送に特異的に関与しているというよりもむしろ、Mrp3の構造の保持、基質全般(胆汁酸、グルクロン酸抱合体)の輸送に必須な構造形成に関与しているものと考えられた。 G、TCの輸送共に認められなかった。このことより、Mrp3においては1084番目のアミノ酸は必ずしもMrp2で見られたように胆汁酸の輸送に特異的に関与しているというよりもむしろ、Mrp3の構造の保持、基質全般(胆汁酸、グルクロン酸抱合体)の輸送に必須な構造形成に関与しているものと考えられた。  Fig.3 胆汁酸輸送に及ぼすMrp2の1096番目、及びMrp3の1084番目のアミノ酸の影響 Fig.3 胆汁酸輸送に及ぼすMrp2の1096番目、及びMrp3の1084番目のアミノ酸の影響 【まとめ】本研究に於いて、私はラットMrp2の基質認識/輸送に関与するアミノ酸について検討を行い、以下のことを明らかにした。 (1)グルタチオン抱合体とグルクロン酸抱合体は必ずしも同一の部位によって認識されないこと (2)TM6、TM11がグルタチオン抱合体の認識或いは輸送に重要であること (3)Mrp2は潜在的な胆汁酸輸送能を有し、その認識/輸送形式はMrp3のそれとは異なること 以上、膜貫通部位に存在するチャージを有するアミノ酸が、Mrp2の基質認識性を決定する要因の一つであることが示された。本研究は、基質特異性が多岐に渡るMRPファミリーにおいて、基質認識部位に関する情報を与えた初めての例であり、MRPファミリーの関与する多剤耐性獲得機構、或いはMrp2を介した胆汁排泄機構の研究に貢献するものと思われる。 |