神経細胞はシナプスを介して入力してくる信号を統合・伝達することで情報処理を行っている。神経細胞の活動性は、それ自体に投射している興奮性シナプスと抑制性シナプスの相対的な数と強度によって決定され、さらにシナプス伝達効率が神経活動依存的に変化すること、つまりシナプス可塑性により高度な情報処理が可能となる。興奮性シナプスにおける可塑性は、記憶・学習の基礎過程として知られ精力的に研究が進められている。一方、抑制性シナプスに関しては、癲癇などの神経細胞の異常興奮を伴う疾患において伝達効率が変化していることが知られているが、可塑性については未だ明らかになっていない。そこで本研究では、ラット海馬CA1野の抑制性シナプスにおいて神経活動に依存した可塑的変化が誘導されることを明らかにし、その誘導機構について検討した。 ラット海馬スライスのCA1野錐体細胞をwhole cell patch clampし、シナプス後電流を記録した。電極内液組成と保持電位などの条件を工夫し、選択的グルタミン酸(AMPA型)または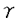 -アミノ酪酸(GABAA型)受容体拮抗薬を添加することにより、興奮性と抑制性シナプス伝達を分離して解析できるようにした。 -アミノ酪酸(GABAA型)受容体拮抗薬を添加することにより、興奮性と抑制性シナプス伝達を分離して解析できるようにした。 細胞の脱分極を妨げないようにcurrent-clamp下にシータ波様刺激(TBS)を与えると抑制性シナプス応答が一過性に減弱(STDGABA-A)した。TBSを繰り返すとシナプス伝達の抑制が持続(LTDGABA-A)した。従って、海馬CA1野錐体細胞に入力する抑制性シナプスにおいても入力刺激の頻度に依存して可塑的変化が誘導されることが明らかになった。 次に、抑制性シナプス可塑性の誘導機構について検討した。細胞内にBAPTAを導入するとLTDGABA-Aのみが完全に抑制された。また、TBS中に膜電位を固定するとSTDGABA-Aは影響を受けなかったがLTDGABA-Aは完全に消失し、むしろわずかに増強した。これらのことから、LTDGABA-Aの誘導には脱分極に伴うシナプス後細胞でのCa2+濃度の上昇が必要であることが示唆された。また、STDGABA-Aは異なる機構で誘導されることも明らかになった。 LTDGABA-Aを誘導するCa2+供給源としては1)NMDA受容体、2)電位依存性Ca2+チャネル(voltage-dependent calcium channel:VDCC)、3)細胞内Ca2+ストアの三つの経路が考えられる。そこで、どの経路がLTDGABA-A誘導に関与しているか検討した。NMDA受容体拮抗薬存在下ではLTDGABA-Aは完全に消失し、むしろ顕著に持続的な増強(LTPGABA-A)が観察された。しかし、L型Caチャネル阻害薬や細胞内Ca2+ストア涸渇薬は何ら影響を与えなかった。これらの結果から、LTDGABA-Aの誘導にはNMDA受容体からのCa2+流入が必要であることが示された。 次に、LTPGABA-Aの誘導機構について検討した。細胞内にBAPTAを導入するとLTPGABA-Aも完全に抑制され、LTDGABA-Aと同様にシナプス後細胞でのCa2+濃度の上昇が必要であることが示された。しかし、シナプス後細胞の脱分極はLTPGABA-A誘導に必須ではなかった。細胞内Ca2+ストア涸渇薬によりLTPGABA-A誘導は完全に抑制された。このことから、LTDGABA-Aの誘導には細胞内Ca2+ストアからCa2+が放出されることが必要であることが示唆された。さらにIP3産生カスケードを阻害するPLC阻害薬あるいはGTPアナログによりLTPGABA-Aの誘導は抑制された。これらの結果から、LTPGABA-Aの誘導にはG蛋白質共役型受容体の活性化とそれに伴うIP3産生カスケードの活性化が必要であることが示唆された。 本研究では海馬CA1野錐体細胞での抑制性シナプス伝達における可塑的変化について検討し、(1)抑制性シナプスにおいてもシナプス伝達効率が変化し、入力刺激頻度に依存してSTDGABA-A、LTDGABA-A、LTPGABA-Aが誘導されること、(2)STDGABA-Aの誘導はシナプス後細胞の脱分極や細胞内Ca2+濃度の上昇に依存しないが、LTDGABA-AではNMDA受容体の活性化に依存して可塑性の方向が決定されること、(3)LTDGABA-AおよびLTPGABA-A誘導にはいずれもシナプス後細胞での濃度の上昇が必要であるが、前者はNMDA受容体を介したCa2+流入、後者にはIP3産生カスケードを介した細胞内Ca2+ストアからのCa2+放出が必要であること、を明らかにした。 本研究により初めて明らかにされた抑制性シナプスの特性は、従来の興奮性シナプス可塑性だけでは説明ができなかった発達期のシナプス形成や癲癇といった現象解明に新たな突破口を提供するものである。従って、博士(薬学)の授与に値する内容であると判断した。 |