| 1.背景 電位依存性Ca2+チャネルは、少なくとも 1、 1、 2/ 2/ 、 、 の3つのサブユニットから構成されている。チャネルの生物物理学的、薬理学的性質は主に の3つのサブユニットから構成されている。チャネルの生物物理学的、薬理学的性質は主に 1サブユニットにより決定されており、現在までに10種類のアイソフォームがクローニングされている。 1サブユニットにより決定されており、現在までに10種類のアイソフォームがクローニングされている。 1Cサブユニットは、心筋、平滑筋、脳を含むほぼ全ての組織に普遍的に発現しており、多彩なスプライスバリアントの存在が示唆されている。 1Cサブユニットは、心筋、平滑筋、脳を含むほぼ全ての組織に普遍的に発現しており、多彩なスプライスバリアントの存在が示唆されている。 1Cサブユニットが構成するチャネルは、電気生理学的、薬理学的性質からL型Ca2+チャネルに分類される。一方、Ca2+拮抗薬はL型Ca2+チャネルに高い親和性を持つが心血管系に選択的に作用し、重篤な副作用がないため臨床上頻用される。特にdihydropyridineは、血管選択性が高いとされており、そのメカニズムについて現在までに様々な研究がなされてきた。組織選択性の一因として、薬物の作用の電位依存性や使用頻度依存性が議論されてきたが、電位依存性L型Ca2+チャネル分子そのものの多様性が関与している可能性が近年示唆されてきた。 1Cサブユニットが構成するチャネルは、電気生理学的、薬理学的性質からL型Ca2+チャネルに分類される。一方、Ca2+拮抗薬はL型Ca2+チャネルに高い親和性を持つが心血管系に選択的に作用し、重篤な副作用がないため臨床上頻用される。特にdihydropyridineは、血管選択性が高いとされており、そのメカニズムについて現在までに様々な研究がなされてきた。組織選択性の一因として、薬物の作用の電位依存性や使用頻度依存性が議論されてきたが、電位依存性L型Ca2+チャネル分子そのものの多様性が関与している可能性が近年示唆されてきた。 本研究は電位依存性L型Ca2+チャネルの組織特異的な分子的多様性と、Ca2+拮抗薬の組織選択性を結びつけるべく、各組織間でのチャネルの分子的相違がどのようにチャネル機能に反映されるのかを明らかにすることを目的とした。 2.スプライスバリアントの組織分布 図1上段に示すとおり、 1Cサブユニットは6回膜貫通モチーフ(S1-S6)が4個(I-IV)連なった構造を取る。現在までに、 1Cサブユニットは6回膜貫通モチーフ(S1-S6)が4個(I-IV)連なった構造を取る。現在までに、 1Cサブユニットにはアミノ末端、IS6、I-II loop、II-III loop、III S2、IV S3、及びカルボキシ末端が異なるスプライスバリアントが存在することが、様々な動物種において報告されている。しかし、単一の動物種においてこれらすべてのバリアントを組織間で比較検討した研究は存在しない。本研究では、個体レベルから分子レベルまでの比較を行いやすいラットを用いて、スプライスバリアントの存在及びその組織分布を検討した。 1Cサブユニットにはアミノ末端、IS6、I-II loop、II-III loop、III S2、IV S3、及びカルボキシ末端が異なるスプライスバリアントが存在することが、様々な動物種において報告されている。しかし、単一の動物種においてこれらすべてのバリアントを組織間で比較検討した研究は存在しない。本研究では、個体レベルから分子レベルまでの比較を行いやすいラットを用いて、スプライスバリアントの存在及びその組織分布を検討した。 ラット組織より抽出したtotal RNAをもとにRT-PCRを行った。ベクターにサブクローニングした後シークエンスを行い、BLASTサーチで相同性を調べた。 結果を図1に示す。ラットでは報告の無かったIS6B2タイプとI-II loop C2タイプが存在することを見出した。これらはウサギ肺由来 1Cサブユニットとアミノ酸レベルでそれぞれ100%、88%の相同性があった。IS6B1タイプとI-II loop C2タイプとの組み合わせは存在を確認できず、2つのスプライシングサイト間に関連性があると考えられた。カルボキシ末端に関してはヒトで2箇所のスプライシングサイトが示唆されているが、ラットにおいては検出することができなかった。これら以外のバリアントはこれまでに報告されているシークエンスと完全に一致した。 1Cサブユニットとアミノ酸レベルでそれぞれ100%、88%の相同性があった。IS6B1タイプとI-II loop C2タイプとの組み合わせは存在を確認できず、2つのスプライシングサイト間に関連性があると考えられた。カルボキシ末端に関してはヒトで2箇所のスプライシングサイトが示唆されているが、ラットにおいては検出することができなかった。これら以外のバリアントはこれまでに報告されているシークエンスと完全に一致した。  図1 スプライシングサイトと配列 図1 スプライシングサイトと配列 シークエンスの結果を基にスプライスバリアントの組織分布を検討した。ラット心室、心房、脳、大動脈、肺、膵臓、肝臓、副腎、胃、小腸、膀胱からtotal RNAを抽出しRT-PCRを行い、制限酵素処理によってバリアントを同定した。一部の組織においてはRNaseプロテクションアッセイを行いRT-PCRの結果と比較した。主な結果を表1にまとめた。アミノ末端においてA2タイプは主に心臓にしか存在しなかったが、PCRの結果ではA1タイプは全ての組織で存在していた。IS6とI-II loopに関しては、脳及び心臓ではB1+C1タイプしかほとんど存在していないことが示された。逆に大動脈や肺など平滑筋ではほとんどB2タイプであり、I-II loopはC1とC2の両方が存在していた。II-III loop D1タイプは、膵臓と肝臓以外の組織ではほとんど見られなかった。IIIS2においては脳ではE1タイプが、副腎ではE2タイプが優勢であった。他の組織ではE1とE2が混在しており、組織間であまり差は見られなかった。IVS3に関しては組織間で大きな差は見られずいずれの組織においてもF3が優勢であったが、副腎のみはIVS3-S4リンカー部位のインサートの無いF2及びF4がほとんどであった。大動脈、胃、膀胱などの平滑筋においてもF4タイプのバリアントがある程度存在していた。総合すると心室と心房でバリアントの差はなく、心筋ではA2+B1+C1+D2+E1/E2+F3タイプが優勢であると考えられる。平滑筋では血管平滑筋と消化管平滑筋で大きな差はなく、A1+B2+C1/C2+D2+E1/E2+F3/F4タイプが優勢であった。全脳を用いたにもかかわらず脳では大部分がA1+B1+C1+D2+E1+F3タイプであった。心筋と血管平滑筋のチャネルの分子的相違には特にアミノ末端、IS6、I-II loop、IVS3が大きく関与していることが示唆される。膵臓や副腎ではさらに異なるスプライスバリアントが発現していた。 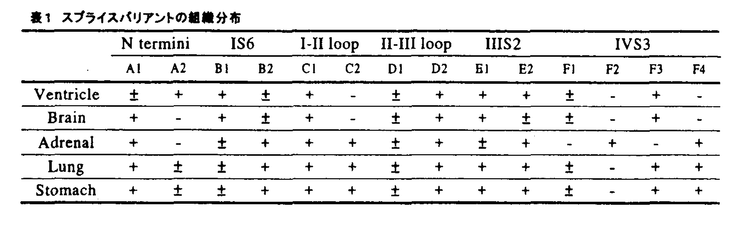 表1 スプライスバリアントの組織分布3.スプライスバリアントL型Ca2+チャネルの機能解析 表1 スプライスバリアントの組織分布3.スプライスバリアントL型Ca2+チャネルの機能解析 電位依存性Ca2+チャネルは生理的には数mMの細胞外Ca2+が存在する条件で機能しており、L型Ca2+チャネル電流は非常に強いCa2+依存性の不活性化を示すことが特徴である。また、dihydropyridineのCa2+チャネルへの結合は細胞外Ca2+濃度の影響を受ける。従って、ネイティブなチャネルと機。能の比較をする上で、発現実験においても生理的濃度のCa2+を透過イオンとして電流を測定することは非常に重要である。しかしCa2+チャネルの発現量は一般に低く、低濃度Ca2+を透過イオンとして 1Cサブユニットを透過するCa2+電流を解析した報告はほとんど存在しない。本研究では 1Cサブユニットを透過するCa2+電流を解析した報告はほとんど存在しない。本研究では 1Cスプライスバリアントのチャネル機能を、Ca2+電流を測定することにより比較検討した。 1Cスプライスバリアントのチャネル機能を、Ca2+電流を測定することにより比較検討した。 ラット脳II型 1Cサブユニット(rbCII)をもとにスプライスバリアントを作成し、 1Cサブユニット(rbCII)をもとにスプライスバリアントを作成し、 2/ 2/ , , 1サブユニットを安定発現したBHK細胞に一過性に発現させた。Ca2+チャネル電流はホールセルパッチクランプ法を用い、細胞外Ca2+濃度は2mM、保持電位は-70mVで測定した。 1サブユニットを安定発現したBHK細胞に一過性に発現させた。Ca2+チャネル電流はホールセルパッチクランプ法を用い、細胞外Ca2+濃度は2mM、保持電位は-70mVで測定した。 rbCII(A1+B1+C1+D1+E1+F3)、IS6をB2に置き換えたバリアント(IS6-B2)、IVS3をF4に置き換えたバリアント(IVS3-F4)のチャネル電流の特徴を比較した。電流電圧曲線と定常状態の不活性化曲線を図2に示す。Ca2+重流は-30mV付近に閾値を持ち、-10-0mVで最大値を示した。いずれのバリアントでも電流電圧関係には差が無く、ネイティブな電位依存性L型Ca2+チャネルとも一致した。定常状態の不活性化のV0.5はrbCII、IS6-B2、IVS3-F4においてそれぞれ、-32.3±1.0mV(n=5)、-38.2±1.2(n=8)、-35.5±1.3(n=5)であり、IS6-B2の不活性化曲線はrbCIIと比べ有意に過分極側ヘシフトしていた。Ca2+チャネル電流の不活性化速度の比較を行った結果を図3に示す。500msのパルスで刺激し、細胞外液2mMCa2+またはBa2+で電流を測定した。電流の不活性化は、Ca2+電流は2次の、Ba2+電流は1次の指数関数でフィットされた。図3に示すとおりBa2+電流の不活性化の時定数とCa2+電流の不活性化の遅い時定数は良く一致し、電位依存性の不活性化成分であると考えられた。IS6-B2チャネルのCa2+流の遅い不活性化のの割合はrbCIIと比べ有意に増加しており、その不活性化速度も速まる傾向にあった。Ba2+電流の不活性化も促進傾向が見られており、IS6-B2のCa2+チャネルにおいては電位依存性不活性化が亢進していることが示唆された。2mM Ba2+を透過イオンとして、電位依存性の不活性化からの回復のキネティックスを検討した。0mV、500msのプレパルスによる不活性化からの回復は、1.5秒以内で起こる速い不活性化と10秒以上を要する遅い不活性化の2種類が観察されたが、各スプライスバリアント間で差はなかった(図4)。Ca2+チャネル電流の薬理学的な性質をnitrendipineを用いて調べたところ用量作用曲線に大きな差は見られなかった(IC50=-100nM)。しかしながら100nM nitrendipineの作用を保持電位-70、-60、-50mVで比較したところ、いずれの電位においてもnitrendipineへの感受性はrbCIIと比べIS6-B2で増大していた(図5)。また、このnitrendipineへの感受性の増大には電位依存性があった。 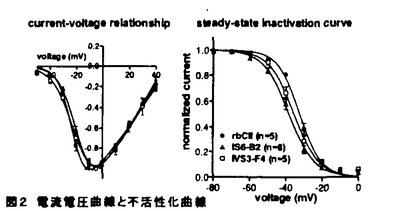 図2 電流電圧曲線と不活性化曲線 図2 電流電圧曲線と不活性化曲線 図3 Ca2+及びBa2+電流の不活性化のキネティックス左:それぞれ同じ細胞から記録したCa2+電流及びBa2+電流の典型例 右上:不活性化速度の時定数 右下:不活性化率 Ca2+電流の不活性化速度は2成分であるため、2成分の和が最大不活性化率となる。*P<0.05vs.rbCII. 図3 Ca2+及びBa2+電流の不活性化のキネティックス左:それぞれ同じ細胞から記録したCa2+電流及びBa2+電流の典型例 右上:不活性化速度の時定数 右下:不活性化率 Ca2+電流の不活性化速度は2成分であるため、2成分の和が最大不活性化率となる。*P<0.05vs.rbCII. 図表図4 電位依存性不活性化からの回復1.5秒以内の速い成分のみを示す。 / 図5 Nitrendipineの電位依存的抑制 100nM nitrendipineのCa2+電流の抑制作用を保持電位-70,-60,-50mVで比較した。*P<0.05vs.rbCII.4.まとめ 図表図4 電位依存性不活性化からの回復1.5秒以内の速い成分のみを示す。 / 図5 Nitrendipineの電位依存的抑制 100nM nitrendipineのCa2+電流の抑制作用を保持電位-70,-60,-50mVで比較した。*P<0.05vs.rbCII.4.まとめ 以上の結果から、電位依存性Ca2+チャネル 1Cサブユニットスプライスバリアントの組織特異的な発現が、各組織における電位依存性L型Ca2+チャネルの生物物理学的、薬理学的相違に関与していることが強く示唆される。特にIS6オルタナティブスブライシングサイトは心筋細胞や中枢神経細胞のL型Ca2+チャネルと血管平滑筋細胞のL型Ca2+チャネルのdihydropyridineに対する感受性の相違の一部を説明する。またこれらの部位におけるL型Ca2+チャネルの電位依存性の不活性化や静止電位におけるavailabilityに差異があることも示唆している。今後、single-cell RT-PCR法などを用いて個々の細胞レベルで 1Cサブユニットスプライスバリアントの組織特異的な発現が、各組織における電位依存性L型Ca2+チャネルの生物物理学的、薬理学的相違に関与していることが強く示唆される。特にIS6オルタナティブスブライシングサイトは心筋細胞や中枢神経細胞のL型Ca2+チャネルと血管平滑筋細胞のL型Ca2+チャネルのdihydropyridineに対する感受性の相違の一部を説明する。またこれらの部位におけるL型Ca2+チャネルの電位依存性の不活性化や静止電位におけるavailabilityに差異があることも示唆している。今後、single-cell RT-PCR法などを用いて個々の細胞レベルで 1Cサブユニット遺伝子とL型Ca2+チャネル電流との対応を検討することにより、 1Cサブユニット遺伝子とL型Ca2+チャネル電流との対応を検討することにより、 1CサブユニットスブプライスバリアントとL型Ca2+チャネル機能との連関をさらに明らかにすることができるであろう。 1CサブユニットスブプライスバリアントとL型Ca2+チャネル機能との連関をさらに明らかにすることができるであろう。 |