| 内容要旨 | | Multidrug resistance-associated protein 1(MRP1)は多剤耐性癌細胞より抗癌剤あ排出ポンプとして同定されたが、その後MRP1発現細胞より調製した膜ベシクルを用いることにより、MRP1がグルタチオン抱合体、グルクロン酸抱合体を含む有機アニオン性化合物をATP依存的に輸送することが示された。このMRP様活性は種々体細胞においても確認されている。例えばcanalicular multispecific organic anion transporter(cMOAT)は肝細胞胆管側膜に存在し、種々の有機アニオン性化合物のATP依存的な胆汁排泄に関与している。cMOATは当研究室を含む幾つかの研究室でcDNAクローニングが成され、MRP1との構造上、機能上の類似性からMRP2とも称されている。一方私は、cMoat/Mrp2を欠損するため黄疸症状を呈する変異ラットEHBR(Eisai Hyperbilirubinemic rat)から調製した膜ベシクルにおいても、ある種の有機アニオン性化合物のATP依存的輸送能力がある程度維持されていることから、MRP1、2以外のMRPホモログが存在する可能性に着目した。修士課程において私はMRP1とのホモロジーに基づき、新規蛋白MLP-1、MLP-2(MRP Like Protein)を見出し、そのcDNAクローニングを行った1)。この研究をきっかけとして種々のMRPホモログが見出され、現在では命名法も統一されMRP1〜6の分子からなるMRPファミリーとして確立されている。MLP-1、2はそれぞれMrp6、Mrp3に対応する。このうちMrp3は、ラットにおいて正常時には消化管に高発現している一方で、肝臓ではEHBRにおいて顕著な発現亢進が観察されたことから、黄疸症状、胆汁うっ滞と関連して誘導されることが示唆された1)。そこで私はMrp3の生理的機能を明らかにすることを目的としてMrp3 cDNA産物の機能解析、臓器における局在性について検討を加えた。 結果(1)Mrp3による有機アニオン性抱合化合物の輸送2) クローン化したMrp3 cDNAの機能を解析するため、Mrp3を哺乳類発現ベクタ-pcXN2に組み込み、ブタ腎由来培養細胞LLC-PK1に導入した。得られたMrp3安定発現細胞より細胞膜ベシクルを調製し、MRP1、2の典型的な基質として知られる、グルタチオン抱合体(2,4-dinitrophenyl-S-glutathione(DNP-SG)、leukotriene C4(LTC4))及び、グルクロン酸抱合体(17 estradiol 17 estradiol 17 -D-glucuronide(E217 -D-glucuronide(E217 G)、E3040 glucuronide)の輸送をATP存在下、非存在下で測定した(Fig.1)。E217 G)、E3040 glucuronide)の輸送をATP存在下、非存在下で測定した(Fig.1)。E217 G、E3040-glucuronideのATP依存的取り込みはMrp3トランスフェクションにより有意に亢進したが、LTC4、DNP-SGの輸送はMrp3及びコントロールベクター導入細胞間で有為な差が見られなかった。すなわちMrp3はグルクロン酸抱合体を良好な基質とするものの、グルタチオンに対する認識力は弱いという点で、MRP1、2と異なる基質認識性を有することが示された。 G、E3040-glucuronideのATP依存的取り込みはMrp3トランスフェクションにより有意に亢進したが、LTC4、DNP-SGの輸送はMrp3及びコントロールベクター導入細胞間で有為な差が見られなかった。すなわちMrp3はグルクロン酸抱合体を良好な基質とするものの、グルタチオンに対する認識力は弱いという点で、MRP1、2と異なる基質認識性を有することが示された。 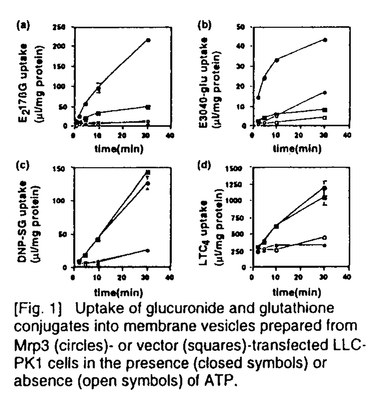 [Fig.1]Uptake of glucuronide and glutathione conjugates into membrane vesicles prepared from Mrp3(circles)-or vector(squares)-transfected LLC-PK1 cells in the presence(closed symbols)or absence(open symbols)of ATP.(2)Mrp3による非抱合性有機アニオン化合物の輸送2) [Fig.1]Uptake of glucuronide and glutathione conjugates into membrane vesicles prepared from Mrp3(circles)-or vector(squares)-transfected LLC-PK1 cells in the presence(closed symbols)or absence(open symbols)of ATP.(2)Mrp3による非抱合性有機アニオン化合物の輸送2) 前述の抱合化合物に加え、MRP1、2は種々の非抱合性の有機アニオン性化合物をも基質とする。Methotrexateはカルボキシル基を有する抗癌剤であるが、Mrp3導入LLC-PK1細胞細胞より調製した膜ベシクルにおいて、顕著なATP依存的輸送活性の亢進が観察され、Mrp3の基質となることが示された。 (3)Mrp3による胆汁酸の輸送3) 胆汁うっ滞時には様々な内因性胆汁成分の肝臓中レベルが上昇し肝臓にダメージを与える。このような病態時にはラットのみではなくヒトにおいてMRP3発現レベルが上昇することが示唆されている。Mrp3の内因性基質を調べる目的で、胆汁の主要構成要素である胆汁酸の輸送を調べた。胆汁酸の胆汁排泄には既に多くの報告があり、胆汁酸の主成分であるタウロコール酸(TC)、グリココール酸(GC)等のmonovalentな胆汁酸はBile salts export pump/sister of P-glycoprotein(spgp)が、また、タウロケノデオキシコール酸や及びタウロリトコール酸の硫酸抱合体(TCDC-S及びTLC-S)等の抱合化された胆汁酸はcMoatMrp2によってそれぞれ胆汁排泄される。遺伝子導入LLC-PK1細胞から調製した膜ベシクルにおいてmonovalent胆汁酸(TC、GC)及び硫酸抱合化胆汁酸(TCDC-S、TLC-S)のATP依存的輸送を調べたところ、どちらのタイプの胆汁酸もMrp3導入株において輸送活性が顕著に亢進しており(Fig.2)、Mrp3が種々の胆汁酸を基質として認識することが明らかとなった。 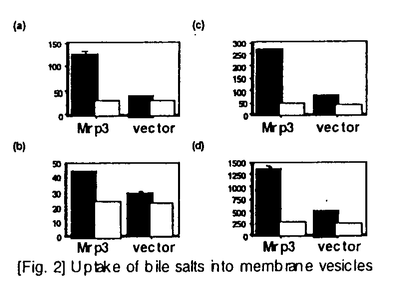 [Fig.2]Uptake of bile salts into membrane vesicles(4)Mrp3の肝臓、小腸における局在性の検討 [Fig.2]Uptake of bile salts into membrane vesicles(4)Mrp3の肝臓、小腸における局在性の検討 抗ラットMrp3及び抗ヒトMRP3抗血清を用いて、肝臓及び小腸におけるMRP3/Mrp3の組織分布を調べた。SDラット肝臓では染色が見られなかったのに対し、EHBRの肝臓では肝細胞の血管側膜にMrp3の局在が観察された。また、ヒト正常肝組織では、肝細胞におけるMRP3の発現は見られないのに対し、肝内胆管上皮細胞(cholangiocyte)の血管側膜にMRP3の染色が観察された。また、ヒト空腸組織において、MRP3は上皮細胞に発現しており、肝細胞や肝内胆管上皮細胞と同様に、血管側膜に局在することが明らかとなった。 まとめと考察 本研究において、ラットMrp3がグルクロン酸抱合体、非抱合型有機アニオン性化合物、胆汁酸等の様々な有機アニオン系化合物を基質として輸送することが明らかとなった。また、(1)グルタチオン抱合体に対する輸送活性は極めて低い、(2)MRP1、2には認識されないTC、GC等のmonovalentな胆汁酸がMrp3の良好な基質となるという2点において、MRP1、2とは明確な輸送特性の相違を持つことが明らかとなった。これはMRPファミリー内で明確な基質特異性を示した初めての例であり、MRP分子の基質認識機構の研究に貢献するものと思われる。 また、MRP3はヒト消化管上皮細胞、及び肝内胆管上皮細胞の血管側膜に発現していた。これら両上皮細胞の管腔側膜にはIBAT(Ileal Bile Acid Transporter)が存在しており、消化管管腔、及び胆汁中からの胆汁酸の吸収への関与が示唆されている。一方、血管側膜に存在するMRP3/Mrp3は胆汁酸を細胞内から血中に排出する機能を担い、IBATと共同して胆汁酸の腸管循環、及び、chole hepatic circulationに重要な役割を果たしている可能性が考えられる(Fig.3)。また、胆汁うっ滞(cholestasis)等の病態肝においては、胆汁酸や異物の胆汁排泄に関与するspgpやcMoat/Mrp2など胆管側膜に存在する輸送体の発現の低下が報告されているが、MRP3/Mrp3はこのような病態時に血管側膜に誘導され、肝臓内に溜まった内因性、外因性の異物を血中に排出することで肝臓の毒性軽減に貢献していると考えられる(Fig.4)。 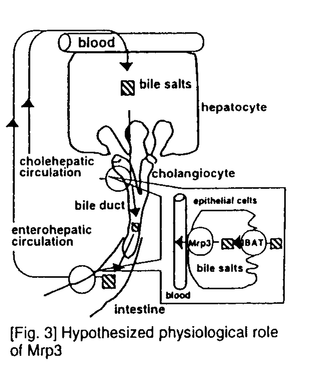 [Fig.3]Hypothesized physiological role of Mrp3 [Fig.3]Hypothesized physiological role of Mrp3 [Fig.4]Induction of Mrp3 in hepatocytes under cholestatic conditions. [Fig.4]Induction of Mrp3 in hepatocytes under cholestatic conditions. 以上、本研究によりMrp3が黄疸、胆汁うっ滞時に肝臓から血中への異物排出という解毒機能を有することに加え、正常時においても生体内の胆汁酸のリサイクルという生理的役割を果たすことが示唆された。 参考文献[1]Hirohashi,T.,Suzuki,H.,Ito,K.,Ogawa,K.,Kume,K.,Shimizu,T.,and Sugiyama,Y.Mol.Pharmacol.53,1068-1075(1998)[2]Hirohashi,T.,Suzuki,H.,and Sugiyama,Y.J.Biol.Chem.274,15181-15185(1999)[3]Hirohashi,T.,Suzuki,H.,Takikawa,H.,and Sugiyama,Y.J.Biol.Chem.,275,2905-2910(2000) |