学位論文要旨
| No | 126270 | |
| 著者(漢字) | 池,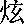 錫 錫 | |
| 著者(英字) | ||
| 著者(カナ) | チィー,ヒョンソク | |
| 標題(和) | ミオシン重鎖、細胞骨格チューブリン及びストレスタンパク質αB-クリスタリンからみた横紋筋の特性 | |
| 標題(洋) | ||
| 報告番号 | 126270 | |
| 報告番号 | 甲26270 | |
| 学位授与日 | 2010.04.22 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(学術) | |
| 学位記番号 | 博総合第997号 | |
| 研究科 | 総合文化研究科 | |
| 専攻 | 広域科学 | |
| 論文審査委員 | ||
| 内容要旨 | 第1章 研究の背景 筋細胞は筋組織を形成し、身体における動力を提供する機能性を持つ。骨格筋は刺激に応じて必要なタンパク質を発現することから、刺激によって適切に変化することが可能であるという特徴を持っている。筋においてこうした適応を誘導する要因となるのは神経刺激、内分泌刺激、力学的な力などが挙げられる。これらのいくつかの要因によって、筋肉は前駆細胞から筋芽細胞を経て筋管までの筋形成段階において、細胞レベルで変化する一連の適応過程を経るといえる。 筋組織の効率的な適応に影響を及ぼす要素としては、まず運動ニューロンによる電気的刺激の差が関係すると考えられる。次に筋細胞のほとんどを占める収縮関連タンパク質であるミオシン頭部のアイソフォームの差や、筋細胞内の分子タンパク質量の差等が関連すると考えられる。本研究ではこうしたタンパク質の量的変化に注目した。その理由としては、機能性を持つタンパク質の量の変化に注目することで、筋が形態的、代謝的、機能的に分類される理由に対する一つの答えに近づくと考えたからである。この過程から得られた結果は筋の適応性を解釈するために有用な一つの解答を与えるものと期待した。 そのために本研究で注目した目的タンパク質は、細胞骨格タンパク質とそれを基質とするシャペロンタンパク質である。これらのタンパク質に注目した理由は、動的な細胞骨格タンパク質のネットワーク及び骨格構造が、筋への機械的な刺激にどう対応するのか、またそれをどういう形で代謝的及び形態的に変換を誘導するのかについて、細胞骨格タンパク質とそれを基質とするシャペロンタンパク質との相互関連を見ながら検討することで、筋の適応性に対する一つの解釈が得られると考えられるためであった。そのために、筋分化が進んだ成熟した横紋筋における細胞骨格タンパク質の一つであるチューブリンと、シャペロンタンパク質の一つであり、チューブリンを基質とするαB-クリスタリンに注目した。さらに、筋の機能的及び代謝的特性を決める一つの指標としてミオシン重鎖アイソフォーム比を取り上げ、これら3つのタンパク質について検討した。 第2章 横紋筋におけるミオシン重鎖、チューブリン、αB-クリスタリンの相互関係 まず第2章では、身体を構成する11種類の異なる部位で異なる働きをする横紋筋(心房、心室、咬筋、舌、横隔膜、ヒラメ筋、足底筋、腓腹筋、長指伸筋、前脛骨筋、大腰筋)を採取し、本研究で注目した3つのタンパク質(チューブリン、αB-クリスタリン、ミオシン重鎖アイソフォーム)を定量した。その結果、ミオシン重鎖Iが優位に発現するヒラメ筋とミオシン重鎖αが優位に発現する心房や心室では、他の筋に比べてチューブリン量とαB-クリスタリン量が多く発現していることを確認した。その反面、ミオシン重鎖IIbが優位に発現する足底筋、腓腹筋、長指伸筋、前脛骨筋、大腰筋ではチューブリン量とαB-クリスタリン量が少ないことを確認した。ミオシン重鎖IIdが優位に発現する咬筋、舌、横隔膜でのチューブリン量とαB-クリスタリン量は、ミオシン重鎖I及びミオシン重鎖αが優位に発現した筋と、ミオシン重鎖IIbが優位に発現した筋との間に位置することを確認した。この結果は、αB-クリスタリンとチューブリンは筋線維を構成する収縮タンパク質のタイプと関係があることを示し、αB-クリスタリン/チューブリンシステムは、異なるミオシン重鎖アイソフォームで構成される多様な筋が受ける異なるメカニカル刺激(部位による伸張度やダイナミクスの違い等)による筋の適応に関連することが示唆される。 第3章 除負荷により萎縮したラット下肢筋におけるαB-クリスタリン、チューブリン、ミオシン重鎖量の相関性 次に、筋の適応の特性を調べるために、15日間の後肢懸垂を行い、筋の萎縮を誘導して除負荷刺激の影響が最も大きいとされる下肢の骨格筋(ヒラメ筋、足底筋、腓腹筋、前脛骨筋)を採取し、3つの注目したタンパク質の量的変化を同様の方法を用いて調べた。体重に対しての筋重量はヒラメ筋(約48%萎縮)、足底筋(約16%萎縮)、腓腹筋(約21%萎縮)で減少し、それとともに各筋でのミオシン重鎖も速筋化が起こり、さらにαB-クリスタリン(最大約42%減少)とチューブリン(ヒラメ筋だけで約33%減少)も有意に減少した。しかし後肢懸垂の間、吊り下げられた状態で下肢の底屈現象が観察され、その間に結果的に伸張(ストレッチ)されている背屈筋である前脛骨筋では萎縮は起こらなかった。またそのミオシン重鎖アイソフォームは遅筋方向へ増加傾向を示し、チューブリン量も変化しなかった。さらにαB-クリスタリンがむしろ約47%有意に増加したことも明らかになった。ただし、この後肢懸垂モデルでは、神経はインタクトであり、この結果が後肢懸垂の間、下肢の底屈現象による筋の伸張(ストレッチ)によるものか、あるいはその間に起こっている伸張性収縮が関与しているのかは区別できない。 第4章 筋の受動的なストレッチが筋のαB-クリスタリン、チューブリン及びミオシン重鎖アイソフォームの発現に及ぼす影響 15日間の後肢懸垂刺激を行った第3章の結果として、後肢懸垂の間に足関節における底屈が起こることにより、伸張状態が続いた前脛骨筋では屈筋であるヒラメ筋、足底筋、腓腹筋における3つのタンパク質量の変化とは異なる変化様相を示し、αB-クリスタリンの有意な増加とともに遅筋化の傾向が見られた。ただしこの結果では、3つのタンパク質の変化が筋のストレッチによる影響だったのか、神経からの刺激による影響による結果だったのかが明らかになっていないため、第4章では萎縮刺激とは異なる過負荷刺激である伸張性収縮刺激を下肢筋に曝し、本研究でターゲットとした3つのタンパク質の量的変化を定量した。その結果ヒラメ筋ではミオシン重鎖Iの比率が有意に増加すること、ミオシン重鎖IIaの比率が有意に減少することが確認できた。一方αB-クリスタリン量に有意な変化は見られず、またチューブリン量は有意に減少(約78%)した。この結果はイソフルランによる麻酔が効いている状態で受動的な伸張刺激を受けたためだと考えられ、チューブリンの発現には神経系の制御が関係することが示唆された。 第5章 終章 本研究ではαB-クリスタリン、チューブリン、そしてミオシン重鎖の筋内タンパク質量が筋肉のタイプ(遅筋及び速筋)及び種類(生体内での付着位置による収縮及び伸張状態)に応じて変化することを明らかにした。またαB-クリスタリン量とチューブリン量が高い相関を持つこと、3つのグループ(MHCI、MHCIId、MHCIIb)のミオシン重鎖タンパク質の順(MHCI>MHCIId>MHCIIb)にαB-クリスタリンもチューブリンもタンパク質量が高かったことを確認した。しかし、より細かく検討するとミオシン重鎖アイソフォームの比率が同様でも、αB-クリスタリンとチューブリンの関係には差が見られたことから、これらのタンパク質量は筋の機能性や異なった付着位置による力学的な環境の差にも依存すると考えられる。また第3章の研究から、筋の収縮及び伸張が3つのタンパク質量の変化に影響を与えることも明らかになった。一方、第4章でのイソフルラン麻酔下でヒラメ筋に伸張刺激を加えた実験では、αB-クリスタリンとチューブリンの筋線維タイプ依存的な量的変化が認められなかった。その理由として各々のタンパク質を制御する調節因子が異なることが示唆された。また、本研究でターゲットとした3つのタンパク質量は、異なった物理的な力が刺激として加わることに対する分子レベルでの筋組織の対応性、及び筋の長さや伸張度などがかかわる筋独特の機能性による影響とも密接に関係すると考えられた。 成熟した横紋筋におけるチューブリン/微小管の研究はほとんどない。本研究の結果は、αB-クリスタリンの多寡が微小管のダイナミクスに関連するというFujitaら、Sakuraiらの先行研究における推察を裏付けるものになった。これらのタンパク質は筋細胞レベルでの生命維持、環境変化に対する適応性において重要なタンパク質であると考えられるため、各筋におけるαB-クリスタリンとチューブリンの量は、横紋筋の適応能の新しい側面-ダイナミクスの維持-を反映していることが考えられる。異なる機械的刺激による異なる筋の伸張及び収縮と筋の適応との関係において、本研究で注目したタンパク質量の変化が深くかかわった可能性があるという点で新しく、新たな視点から筋の適応性を説明する糸口となるものと考えられる。 更なる重要な示唆点として、本研究でチューブリン及び微小管のダイナミックス制御には神経系の作用がかかわる可能性があることが挙げられる。この制御によってチューブリンと微小管が、αB-クリスタリンと一つのシステムを形成し、筋肉のサルコメア構造のダイナミックな保持に関与すること、さらにストレッチに呼応して変動することで、基幹システムとして貢献すると推測される。つまり、ミオシンによって決定される収縮特性に加えて、チューブリンとαB-クリスタリンとの関係によって、「横紋」という骨格筋のシステマチックな収縮構造をダイナミックに維持する構造的特性が持続されると考えられる。 本研究では各々の筋の位置や機能的特性による筋の伸張度及び収縮度が、本研究でターゲットとしたαB-クリスタリン、チューブリン、ミオシン重鎖タンパク質量を調節する重要な因子であることが示唆された。 | |
| 審査要旨 | 筋肉は刺激に応じて自己を変える能力である可塑性が強い。こうした適応を誘導する要因となるのは神経刺激、内分泌刺激、力学的な力などが挙げられ、その結果として必要なタンパク質量を変化させることが、1つの適応方法である。本研究では筋肉の適応性について、タンパク質量の量的変化から検討した。本研究で注目したタンパク質は、細胞骨格タンパク質であるチューブリンと、シャペロンタンパク質でありチューブリンを基質とするαB-クリスタリン、筋肉の機能的及び代謝的特性を決める一つの指標としてミオシン重鎖アイソフォームである。これらのタンパク質に注目した理由は、細胞骨格タンパク質のネットワーク構造は筋肉への機械的刺激への対応に重要であること、さらに細胞骨格タンパク質を基質とするシャペロンタンパク質との相互関連が筋肉の適応について果たす役割が考えられることからである。 まずラットを用いてこれら3つのタンパク質量が安静時にどのような量的関係にあるのかを求めたところ、ミオシン重鎖Iが優位に発現するヒラメ筋とミオシン重鎖αが優位に発現する心房や心室では、他の筋肉に比べてチューブリン量とαB-クリスタリン量が多く発現し、ミオシン重鎖IIbが優位に発現する筋肉ではチューブリン量とαB-クリスタリン量が少ないことを確認した。αB-クリスタリンタンパク質量とチューブリンタンパク質量は高い相関を持ち、ミオシン重鎖タンパク質構成比とαB-クリスタリンもチューブリンとも関係があることを確認した。しかし、より細かく検討をすると同じミオシン重鎖アイソフォームの比率が多くても、αB-クリスタリンとチューブリンの関係には差が見られたことから、筋肉内でのこれらのタンパク質量にはその筋肉の機能性、異なった付着位置による力学的な環境の差にも依存することが考えられた。 次に15日間の後肢懸垂を行い、筋肉の萎縮によって、3つのタンパク質量がどう変化するのかについて検討した。その結果チューブリンとαB‐クリスタリンはどちらも減少し、ミオシン重鎖も速筋化が起こることが明らかとなった。ただしこの時結果として伸張状態にあった筋肉では萎縮は起こらず、ミオシン重鎖アイソフォームは遅筋方向へ増加傾向を示し、チューブリン量は変化せず、αB‐クリスタリンは増加した。そこで次に筋肉の伸張刺激が3つのタンパク質量に影響を与えるのかについて、伸張性収縮刺激を与えた時の変化について検討した。その結果ヒラメ筋で、ミオシン重鎖Iの比率が増加するが、αB‐クリスタリン量に変化は見られず、またチューブリン量は減少した。この結果は麻酔が効いている状態で受動的な伸張刺激を受けたためだと考えられ、チューブリンの発現には神経系の制御が関係することが示唆された。またαB-クリスタリンとチューブリンの筋線維タイプ依存的な量的変化が認められなかったことから、各々のタンパク質を制御する調節因子が異なることが示唆された。 本研究では各々の筋の位置や機能的特性による筋の伸張度及び収縮度が、ターゲットとしたαB-クリスタリン、チューブリン、ミオシン重鎖タンパク質量を調節する重要な因子であることが示された。これらのタンパク質は筋細胞レベルでの生命維持、変化に対する対応性において重要なタンパク質であると考えられることから、この3つのタンパク質の相互関係はこれまで検討されてこなかった筋の適応性を説明する一つの端緒を提供したといえる。 以上から、本審査委員会は博士(学術)の学位を授与するにふさわしいものと認定する。 | |
| UTokyo Repositoryリンク |