学位論文要旨
| No | 126980 | |
| 著者(漢字) | 川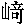 ,範隆 ,範隆 | |
| 著者(英字) | ||
| 著者(カナ) | カワサキ,ノリタカ | |
| 標題(和) | 新規がん転移抑制遺伝子の探索に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 126980 | |
| 報告番号 | 甲26980 | |
| 学位授与日 | 2011.03.24 | |
| 学位種別 | 課程博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 博医第3590号 | |
| 研究科 | 医学系研究科 | |
| 専攻 | 病因・病理学専攻 | |
| 論文審査委員 | ||
| 内容要旨 | 背景 がんの悪性形質は、無秩序な増殖性、体内の栄養素を奪い取る悪液質、周辺組織・臓器への転移である。周辺組織への浸潤能を獲得し、転移巣を形成したがん細胞は、外科的処置による根治が困難であり、予後不良となる。がん疾患が日本における死亡原因のトップであり続ける主因は、このがん細胞の転移能の獲得にある。したがって、がん細胞の転移機構の理解と抑制手法の開発は、がん研究分野における最重要課題の1つとして精力的に展開されている。 がん細胞が悪性化し転移能を獲得するに至るまでには、遺伝子の増幅や転座、欠損、点変異が起きている。その結果、細胞機能の異常な活性化が起こっていたり、その活性化を制御する機構が破綻したりしている。 一方、正常細胞には、転移性がん細胞で認められる細胞機能の変化を抑制的に制御する機構が働いていると考えられる。そのような制御に関与するがん転移抑制遺伝子は、転移性がん細胞では発現の欠損や機能の消失が起きていると推察される。そのため、がん転移に対して抑制的に働く分子の探索は、正常細胞とがん細胞の比較、あるいは低転移性のがん細胞と高転移性のがん細胞の比較により行われてきた。そのような手法は、悪性形質を獲得した細胞と、そうでない細胞とを比較しているため、遺伝子発現やタンパク質翻訳・修飾などが大きく異なる細胞間での比較となる。したがって、同定される遺伝子数が膨大となることもしばしばで、悪性形質の獲得における直接的・間接的影響、貢献度の多寡、原因と結果の判断が困難となる場合が多く認められる。 このような問題点を回避できる手法として、RNAi技術があげられる。RNAiは二本鎖RNAによって、その配列特異的にmRNAが分解され、遺伝子の発現が抑制される現象である。RNAi技術によりあらかじめ特定の遺伝子の発現を抑制することで、その発現抑制に依存する細胞の形質変化を研究することが可能となった。がん研究の分野においても、増殖、運動、細胞死といった細胞機能に関わる新規遺伝子の探索・同定に貢献している。また、外因性に遺伝子を発現させるcDNAライブラリーと異なり、遺伝子の生理的発現範囲内での解析を行えるという利点も持ち合わせている。 同様の原理に基づき、本研究では、ヒト全遺伝子を網羅するRNAiライブラリーを用いて、がん転移分子機構の解明を目的として、新規がん転移抑制遺伝子の探索を行った。スクリーニング方法には、がん転移の臨床を反映できるマウス実験的転移モデルを採用した。 RNAiライブラリーを低転移性のがん細胞に導入し、マウス尾静脈より移植、転移巣からがん細胞を回収した。続いて、回収したがん細胞において発現が亢進したsiRNAを同定し、同siRNA配列が標的とする遺伝子をがん転移抑制遺伝子の候補とした。その結果、23遺伝子をがん転移抑制遺伝子として同定した。さらに、23遺伝子中に含まれる機能未知タンパク質NDUFV3が、がん細胞の運動性に抑制的に働くことを明らかとした。 結果 RNAiライブラリーを導入したヒト肺腺がん由来PC-8細胞株(PC-8 Lib)を作製し、ヌードマウスの尾静脈より移植した。同ヌードマウスを、SPF環境下で90日間飼育し観察したところ、16匹中1匹のヌードマウスにおいて両膝付近に転移巣が観察された。ヌードマウスを犠牲死させ、両膝よりそれぞれ腫瘍塊を回収し、初代培養法により培養細胞として単離した。得られた細胞株について、PC-8 Lib細胞株に対するsiRNAの増減をそれぞれマイクロアレイ解析した。その結果、in vivoスクリーニングにより合計23遺伝子に対するsiRNA配列が2倍以上に増幅されていた。PC-8細胞株における23遺伝子の発現を検討したところ、19遺伝子のmRNAを検出した。そのため、19遺伝子について、解析を行うこととした。 尾静脈移植によりスクリーニングを選択したので、候補遺伝子はがん細胞が脈管外へと脱出する機構を制御する遺伝子であると推察される。脈管外への脱出は、細胞運動を伴った一連の過程が必要とされていることが知られている。そこで、候補遺伝子が細胞運動に与える影響を、in vitroで簡便に行えるトランスウェルマイグレーションアッセイを用いて検討した。19遺伝子中15遺伝子のshRNA安定発現細胞株を作製し、それらを用いて運動能を評価した。コントロール細胞株に対して、NDUFV3、THPO、PALM2の発現抑制細胞株において、いずれも4倍程度の顕著な運動能の亢進が認められた。 さらに、運動能亢進を認めた3遺伝子の発現抑制細胞株を用いて、スクラッチアッセイを行ったところ、運動能の亢進を示した。したがって、NDUFV3、THPO、PALM2遺伝子は、細胞運動能を抑制的に制御していることが示唆された。 続いて、PC-8細胞株以外のがん細胞でも、NDUFV3、THPO、PALM2の3遺伝子の発現抑制による細胞運動性の亢進が、認められるかについて検討した。乳がん細胞株由来MDA-MB-231細胞株を用いて、それぞれの発現抑制細胞株を作製し、運動能の評価を行った。いずれの発現抑制株においても、運動能の亢進が認められた。したがって、これら3遺伝子は、PC-8細胞株以外のがん細胞においても運動能の抑制に関与することが示唆された。 in vivoスクリーニングによって、各遺伝子に対するsiRNAは、NDUFV3では4.3倍、THPOでは2.4倍、PALM2では2.1倍に増幅されていた。そこで、本研究では、最も増幅されたNDUFV3に関する解析から始めることとした。 NDUFV3は、核DNAにコードされ、その遺伝子産物は、ミトコンドリア移行配列を有している。NDUFV3遺伝子の転写産物は、オルタナティブスプライシングを受け、473アミノ酸で構成されるバリアント1と108アミノ酸で構成されるバリアント2が存在する。バリアント2は、複合体Iに局在することが分かっているが、その機能は不明であり、バリアント1に関する報告は無い。NDUFV3の発現は、PC-8細胞株および、MDA-MB-231細胞株に加えて、4種類のヒトがん細胞株で確認された。いずれの細胞株においても、バリアント1の発現量が、バリアント2に比べて優位であった。 続いて、NDUFV3の細胞内局在性の検討をウェスタンブロット法で行った。バリアント1、バリアント2共にミトコンドリア画分で検出され、細胞質画分では検出されなかった。したがって、NDUFV3は、バリアント1およびバリアント2共にミトコンドリアに発現することが明らかとなった。 NDUFV3はミトコンドリア呼吸鎖複合体Iを構成するサブユニットの1つである。同複合体を形成するフラボプロテインとして、NDUFV3の他に、NDUFV1および、NDUFV2が知られている。同複合体のフラボプロテインが運動能を抑制的に制御するという報告はなく、フラボプロテインと運動能との関連性を調べた。NDUFV1、NDUFV2に対する発現抑制細胞株をそれぞれ作製し、運動能を検討した。コントロール細胞株と比較して、NDUFV1発現抑制細胞株とNDUFV2発現抑制細胞株では、顕著な運動性の変化は認められなかった。細胞運動能の抑制は、フラボプロテインの酵素活性によるものではなく、NDUFV3特異的な働きであることが示唆された。 ミトコンドリアは、ATPを産生する細胞小器官である。NDUFV3の遺伝子産物がミトコンドリアに局在するため、エネルギー産生系に影響し、運動能を制御しているのではないかと考え、NDUFV3が細胞内ATP濃度に与える影響や、NDUFV3のエネルギー代謝シフトへの関与を検討した。 NDUFV3発現抑制細胞株では、コントロール細胞株と比較して、ATP濃度に差はなく、エネルギー代謝シフトにも影響を及ぼさなかった。したがって、NDUFV3は、エネルギー産生系には影響しないことが示唆された。 続いて、ミトコンドリア呼吸鎖複合体活性を測定した。ミトコンドリアの電子伝達系では、呼吸鎖複合体間での電子の授受が行われている。呼吸鎖複合体はI~Vのサブユニットで構成されており、I~IVはプロトンをマトリックス側から膜間隙に汲み出すポンプとして、VはATPをつくるポンプとして働いている。NDUFV3がATP産生に影響を及ぼさないので、複合体IからIVの活性をそれぞれ測定した。 複合体I、複合体IIでは、NDUFV3発現抑制によって、活性変化は示さなかった。しかし、複合体IIIでは、NDUFV3発現抑制により、活性が約30%低下し、複合体IVでは、活性が約30%上昇していた。以上のことから、NDUFV3が複合体III、IVの活性を制御することが示唆された。 ミトコンドリア呼吸鎖複合体の活性が下がり、電子伝達系が阻害されると、電子と酸素が反応し、活性酸素種が過剰に発生する。活性酸素種の作用は多岐にわたり、細胞死の誘導、運動能や増殖能の亢進、炎症・アレルギー反応の活性化などが挙げられる。NDUFV3の発現抑制により、過剰の活性酸素種が発生して、運動能が亢進された可能性が考えられた。そこで、NDUFV3発現抑制で亢進された運動能が抗酸化剤によって抑制されるのかを検討した。NDUFV3発現抑制細胞株および、コントロール細胞株をそれぞれ抗酸化剤で処理したところ、両細胞間で有意な運動能の差はなくなった。このことから、NDUFV3が活性酸素種の発生に影響を与え、運動能を制御していることが示唆された。 続いて、細胞内活性酸素種濃度を測定した。NDUFV3発現抑制細胞株では、活性酸素種濃度が約20%上昇していた。その上昇は抗酸化剤により、コントロール細胞株と同濃度までに抑制された。しかし、NDUFV3発現抑制により、顕著な亢進を示す運動能を、説明できる過剰な活性酸素種の発生は認められなかった。したがって、NDUFV3は活性酸素種の発生を制御しているというよりも、活性酸素種シグナルを抑制し、運動性を抑制的に制御していることが示唆された。 結論 本研究のスクリーニングによりがん転移抑制遺伝子の候補を23遺伝子同定した。さらに、その中の1つであるNDUFV3が、細胞運動の制御に関与する分子であることが明らかとした。その制御機構は、活性酸素種シグナルを抑制し、がん細胞の運動を抑制するものであると考えられた。 | |
| 審査要旨 | 本研究は、新規がん転移抑制遺伝子の探索に関する研究を行い、下記の結果を得ている。 1.低転移性ヒト肺腺がん由来PC-8細胞株に、RNAiライブラリーを導入した。その細胞株をヌードマウスの尾静脈より移植し、in vivoスクリーニングを行った。その結果、がん転移抑制遺伝子候補となる23遺伝子を同定した。 2.PC-8細胞株を用いて23遺伝子中15遺伝子それぞれに対する発現抑制細胞株を作製した。それらの運動能評価を行ったところ、NDUFV3、THPO、PALM2遺伝子に対する発現抑制細胞株が顕著な運動能の亢進を示した。さらに、3遺伝子の発現抑制細胞株を用いて、スクラッチアッセイを行ったところ、スクラッチアッセイにおいても運動能の亢進が認められた。これらのことより、NDUFV3、THPO、PALM2遺伝子が、細胞運動を抑制的に制御することを明らかとした。また、その運動能制御は、ヒト乳がん由来MDA-MD-231細胞株においても同様に示された。 3.MDA-MB-231細胞株を用いて、運動能を制御する遺伝子であるNDUFV3の遺伝子産物が、ミトコンドリアに局在することをウェスタンブロット法により明らかとした。 4.MDA-MB-231細胞株を用いて、NDUFV3を発現抑制した際の、細胞内ATP濃度の測定や、エネルギー代謝シフトといったエネルギー産生系に与える影響を検討した。その結果、NDUFV3はエネルギー産生系に影響を与えずに、運動能を制御していることが示された。 5.NDUFV3を発現抑制した際に、ミトコンドリア呼吸鎖複合体活性を測定したところ、複合体III活性を低下させること、複合体IV活性を上昇させることが明らかとなった。 6.抗酸化剤を用いて、活性酸素種が運動能に与える影響を検討した。NDUFV3発現抑制細胞株を抗酸化剤処理すると、亢進された運動能の低下が認められた。さらに、NDUFV3発現抑制細胞株の細胞内活性酸素種の測定を行ったところ、活性酸素種の発生は亢進していたものの、顕著な運動能の亢進を説明できるものではなかった。したがって、NDUFV3は活性酸素種の発生に影響を与えるというよりも、活性酸素種シグナルを抑制し、運動能を抑制的に制御していることが示唆された。 以上より、本論文は、新規がん転移抑制遺伝子の候補を23遺伝子同定したことを報告し、候補遺伝子の1つであるNDUFV3が、細胞運動能を抑制的に制御することを示した。本研究で見出した新規がん転移抑制遺伝子群の情報により、がん転移分子機構の理解が深められると考えられることから、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク |