| 内容要旨 | | 本論文は、松もぐり貝殻虫の性フェロモンの主成分の合成に関するもので二章よりなる。 第一章では、分子内に2個の不斉点を持つ、松もぐり貝殻虫(Matsucoccus feytaudi)の性フェロモン主成分である、(8E,10E)-3,7,9-トリメチル-8,10-ドデカジエン-6-オン[1]の可能な4種の全ての立体異性体の合成について述べる。また、その相対並びに絶対立体配置の決定について述べる。 第二章では、属は同じであるが、種の異なる松もぐり貝殻虫(Matsucoccus matsumurae,M.thumbergianae及びM.resinosae)の性フェロモン主成分である、(2E,4E,6R,10R)-4,6,10,12-テトラメチル-2,4-トリデカジエン-7-オン[2](matsuone)及びその鏡像体の合成について述べる。また、その絶対立体配置の決定について述べる。 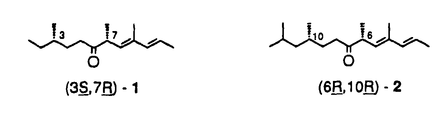 第一章 (8E,10E)-3,7,9-トリメチル-8,10-ドデカジエン-6-オン[1]は、Einhornらにより1990年に単離され、3位、7位の立体化学は不明ではあるが、その構造は[1]であると報告されている。そこでこの、相対並びに絶対立体配置決定を目的として、以下の方法により可能な4種の全ての立体異性体の合成を行った。まず、(3R,7S)-[l]を例にとりその合成について述べる。 3,7-syn体{(3R,7S)-[1]}の合成:分子内に一つの不斉点を持つ(S)-(-)-シトロネロール(S)-[4]を出発原料とし、これを既知の合成法に従い(R)-[6]へと導いた。次にオゾン分解により得られたアルデヒド(R)-[7]にWittig反応を行う事により、幾何異性体比E:Z=94:6で , , -不飽和エステル(R)-[8]を得た。この(R)-[8]はエステル部分を還元し、アリリックアルコール(R)-[9]へと導いた。ここで、不斉エポキシ化反応を行う事により、分子内への更なる不斉の導入を行った。すなわち、(R)-[9]にL-(+)-酒石酸ジエチルを不斉導入の補助剤とするSharplessの不斉エポキシ化反応を行う事により、粗のエポキシアルコール(2S,3S,6R)-[10]を得た。このものは、純度の向上を目的として結晶性誘導体である3,5-ジニトロベンゾエート(2S,3S,6R)-[11]へと導くことにより、再結晶が可能となり、C-2位とC-3位の立体化学に関してほぼ100%e.e.の[11]を得ることができた。精製[11]は精製[10]へと再変換し、Swern酸化によりアルデヒド(2R,3S,6R)-[12]、さらにWittig反応により -不飽和エステル(R)-[8]を得た。この(R)-[8]はエステル部分を還元し、アリリックアルコール(R)-[9]へと導いた。ここで、不斉エポキシ化反応を行う事により、分子内への更なる不斉の導入を行った。すなわち、(R)-[9]にL-(+)-酒石酸ジエチルを不斉導入の補助剤とするSharplessの不斉エポキシ化反応を行う事により、粗のエポキシアルコール(2S,3S,6R)-[10]を得た。このものは、純度の向上を目的として結晶性誘導体である3,5-ジニトロベンゾエート(2S,3S,6R)-[11]へと導くことにより、再結晶が可能となり、C-2位とC-3位の立体化学に関してほぼ100%e.e.の[11]を得ることができた。精製[11]は精製[10]へと再変換し、Swern酸化によりアルデヒド(2R,3S,6R)-[12]、さらにWittig反応により , , -不飽和 -不飽和 , , -エポキシエステル(4S,5S,8R)-[13]へと導いた。 -エポキシエステル(4S,5S,8R)-[13]へと導いた。  [13]は、パラジウム触媒の存在下、エポキシドの位置及び立体選択的な還元的開裂反応により、(4S,5S,8R)-[14]へと導いた。この反応では 位のメチル基は立体反転する事が知られているため、得られたアルコール[14]でのメチル基の配置は、(S)-配置である。 位のメチル基は立体反転する事が知られているため、得られたアルコール[14]でのメチル基の配置は、(S)-配置である。 得られた[14]は水酸基部分を保護し、シリルエーテル(4S,5S,8R)-[15]とし、エステル部分を還元し、得られた(4S,5S,8R)-[16]をSwern酸化によりアルデヒド(4S,5S,8R)-[17]へと導き、Horner-Wittig反応により、ジエンエステル(6S,7S,10R)-[18]とした。このものの1H-NMRにはZ-体のオレフィン性プロトンに対応するであろうシグナルは観測されず、この工程での二重結合の導入もE-選択的であった。 さらに[18]のエステル部分を還元し、(6S,7S,10R)-[19]を得、続いて[19]の水酸基の除去を行い、(6S,7S,10R)-[20]を得た。  [20]の保護基を除去し、得られた粗製アルコールは、分取HPLCにより精製を行い、(3R,6S,7S)-[21]へと導いた。最後に、[21]を酸化する事により、目的化合物である(3R,7S)-[1]を得た。通算収率は(S)-[4]より19工程で3.5%であった。  他の3種の立体異性体の合成:他の3種の異性体の合成に関しては、出発原料として(S)-または(R)-シトロネロール{(S)-[4]または(R)-[4]}を使い分ける事により、また不斉導入の際にL-(+)-またはD-(-)-酒石酸ジエチルを使い分ける事により、同様に行った。通算収率は(3S,7R)-[1]、(3R,7R)-[1]、(3S,7S)-[1]につき、それぞれ1.2%、2.3%、2.8%であった。 天然物の相対並びに絶対立体配置の決定:得られた合成品と天然物との1H-NMRスペクトルの比較により、[1]の相対立体配置は3,7-syn体であり、また生物活性試験の結果より、その絶対立体配置は(3S,7R)-[1]であることが明らかになった。 第二章 (2E,4E,6R,10R)-4,6,10,12-テトラメチル-2,4-トリデカジエン-7-オン(matsuone)[2]は第一章で述べたMatsucoccus feytaudiと種は異なるが、同じ属に属する三種の松もぐり貝殻虫(Matsucoccus resinosae,M.matsumurae及びM.thunbergianae)の性フェロモン主成分としてLanierらにより1989年に単離されたものであり、6位、10位の立体化学は不明ではあるが、その構造は[2]であると報告されている。その後、この相対立体配置に関しては、Kallmertenらにより6,10-synである事が報告された。 そこでこの6,10-syn-[2]の絶対立体配置の決定を目的として、以下の方法により両鏡像体の合成を行った。まず(6S,10S)-[2]を例にとりその合成について述べる。 (6S,10S)-[2]の合成:出発原料である(S)-(-)-シトロネロール(S)-[4]より2工程でニトリル(S)-[22]を得た。このもののモノメチル化では、通常望むモノメチルニトリル(2RS,4S)-[23]に混ざってジメチル体(S)-[23a]が副生してしまうが、滴下の際に、ニトリルより調製したアニオンをヨウ化メチルに滴下する逆滴下法を行う事により、ジメチル体を完全に抑制できる事を見いだせたため、これによりモノメチルニトリル(2RS,4S)-[23]を得た。得られた[23]はニトリル部分を還元しアルデヒド(2RS,4S)-[24]とし、更にWolff-Kishner還元によりオレフィン(S)-[25]へと導いた。  このオレフィン(S)-[25]は第一章でのオレフィン(R)-[6]と非常に類似した構造を持っているため、(S)-[25]のオレフィン部分を足がかりとすれば、第一章での方法と同様な方法により最終目的化合物(6S,10S)-[2]を合成する事ができると予想される。そこでこの方法に従って合成を進め、実際、分子内への不斉導入ならびにその不斉を損なうこと無く、(S)-[25]より17工程で最終目的化合物(6S,10S)-[2]の合成が可能であった。通算収率は(S)-[4]より22行程で2.6%であった。 (6R,10R)-[2]の合成:鏡像体である(6R,10R)-[2]の合成も同様に行い、通算収率は(R)-[4]より2.2%であった。 天然物の絶対立体配置の決定:合成品[2]の両鏡像体のNMRスペクトルは天然物のフェロモンのそれと完全に一致し、また6,10-synの相対立体配置を持つKallmertenらの合成品のそれとも完全に一致した。さらに、生物活性試験の結果より、天然物のフェロモンの絶対立体配置は(6R,10R)-[2]である事が明らかになった。 |
| 審査要旨 | | 本論文は,松もぐり貝殼虫の性フェロモンの主成分の合成に関するもので二章よりなる。個体間の交信物質として重要な機能を持つ昆虫フェロモンの中には,立体異性や幾何異性があったり,化学的に不安定な構造を持ち,極く微量なために構造決定に到らぬ場合が未だに多い。著者はこの点に着目し,とくに立体化学的に不安定な構造を有する昆虫フェロモン類を高純度で得る合成法を確立すると共に立体構造を確定することを目的として以下の研究を行った。 序論で研究の背景と意義について概説したのち,第一章では松もぐり貝殻虫(Matsucoccus feytaudi)の性フェロモン主成分である(8E,10E)-3,7,9-トリメチル-8,10-ドデカジエン-6-オン1の可能な4種の全ての立体異性体の合成による相対および絶対立体配置の決定について述べている。 一例として(3R,7S)-1の合成を上図に示す。(S)-シトロネロール(S)-2を原料に用い,鍵反応としてSharplessの不斉エポキシ化を用いてエポキシアルコール(2S,3S,6R)-4を得,3,5-ジニトロベンゾエート5の再結晶を経て高光学純度の4とした。これを不飽和エステル6に導き,エポキシドの位置および立体選択的還元開裂反応により7を得て目的の骨格を有する(3R,6S,7S)-8へ変換した。最後に注意深く酸化することにより,不安定なC-7メチル基を異性化させることなく高純度の(3R,7S)-1の合成に成功した。通算収率は2より19工程で3.5%であった。全く同様にして,(S)-2ないしは(R)-2を原料とし,Sharplessの不斉エポキシ化の際の不斉リガンドの酒石酸ジエチルを使い分けることにより,残る3種の異性体を全て高純度で合成できた。得られた合成品と天然物との高分解能1H-NMRスペクトルの比較により,天然物1の相対配置は3,7-syn体で,さらに生物活性試験の結果から,その絶対立体配置は,上図に示す(3S,7R)-1であることが判明した。 第二章では,属は前章のものと同じであるが,種の異なる松もぐり貝殼虫類(M.matsumurae,M.thumbergianaeおよびM.resinosae)の性フェロモン主成分である(2E,4E,6R,10R)-4,6,10,12-テトラメチル-2,4-トリデカジエン-7-オン9(Matsuone)のsyn-体の両鏡像体の合成ならびに絶対立体配置の決定について述べている。当初,C-6位,C-10位のメチル基の立体化学は全く不明であったが,後にKallmertenらにより相対立体配置が決定され,syn-体であることが明らかになったので,この両鏡像体の合成を行った。(S)-2を出発原料としニトリル10に導き,反応条件の適正化により目的とするモノメチル体11をジメチル体12の副生を完全に抑制しつつ得ることに成功した。この11を2工程でアルケン13とし,以下は第一章と同様な手法により,(6S,10S)-9を通算22工程,収率2.6%で得ることに成功した。全く同様にして(R)-2から(6R,10R)-9を得た。合成品9の両鏡像体の1H-NMRスペクトルは,天然物およびKallmertenらの合成した6,10-syn体のそれともよく一致した。また生物活性試験の結果から,天然の性フェロモン,Matsuoneの絶対立体配置は(6R,10R)であると決定することに成功した。 以上本論文は,各種立体異性体ならびに幾何異性体が存在する可能性があり,分子内に不安定な化学構造を有するために異性化しやすい松もぐり貝殻虫の性フェロモン類の可能な異性体を高純度で得る合成に関するものである。著者は,位置および立体選択的な反応を用い,不安定要因を排除した合成経路を開拓することにより合成に成功し,高純度サンプルを得るとともに,生物試験に供与することによって絶対立体配置を含めた構造の確定に成功したものであり,学術上貢献するところが少なくない。よって審査員一同は,申請者に博士(農学)の学位を授与してしかるべきものと判定した。 |