学位論文要旨
| No | 211746 | |
| 著者(漢字) | 鹿野,眞弓 | |
| 著者(英字) | ||
| 著者(カナ) | シカノ,マユミ | |
| 標題(和) | カルシトニンの培養細胞に対する作用と構造活性相関に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 211746 | |
| 報告番号 | 乙11746 | |
| 学位授与日 | 1994.04.13 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第11746号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | カルシトニン(CT)は哺乳動物のカルシウム代謝調節に関わるペプチドホルモンで、骨において破骨細胞の骨吸収(骨からのリン酸カルシウム溶出)を抑制し、腎ではvitamin D3-1-a-hydroxylase(活性型vitamin D3生合成酵素)活性やリン酸再吸収を促進する。全身的には体外から吸収したカルシウムを骨に貯蔵する作用を示すことから、高カルシウム血症や骨粗鬆症に対して臨床応用されている。これまでに一次配列が明らかにされた各動物のCTは、その相同性からヒト型、ブタ型、魚類・鳥類型に分けられるが、哺乳動物に対する活性は、魚類・鳥類CT型が他のCTよりはるかに強い。従って魚類・鳥類CTを中心に、製剤開発を目指して構造活性相関が盛んに調べられてきたが、未だ定見は得られていない。その理由の一つに、適当なin vitro活性測定系の確立が遅れていることが挙げられる。従来は主にcAMP定量が行われてきたが、CTによるvitamin D3-1-a-hydroxylase活性促進はcAMPを介さないこと、腎株化細胞でのリン酸取り込みにはC-kinaseの関与等が報告されており、cAMP定量のみでは十分な情報は得られない。本研究においてはCTの構造活性相関を知ることを目的とし、まず株化細胞に対するCTの作用を検討して新しいin vitro活性測定系を構築した。次いで、新視点に基づいてデザインした誘導体の活性を比較することで構造活性相関を知ることを試みた。 ウナギCT(eCT)に対して高い反応性を有する細胞株を選択し、新たなin vitro活性測定法となり得る反応を探索することを企図した。短期作用としてcAMP産生を、長期作用として細胞形態変化を指標とし、腎、血球、乳癌由来の37細胞株の中からブタ腎尿細管上皮由来細胞株LLC-PK1細胞を選択した。 増殖期のLLC-PK1細胞を10-9MのeCT存在下に3日間培養したところ、多数のvacuoleの出現等、細胞形態の著しい変化が観察され、生存細胞数が顕著に減少していた。魚類・鳥類CT、哺乳類CTともLLC-PK1細胞でcAMP産生を促進するが、この形態異常・増殖阻害は魚類・鳥類CTによってのみ惹起された。8-Br-cAMPとphorbolmyristateacetate(PMA)との共存によりLLC-PK1細胞の形態異常・増殖阻害を再現できたことから、魚類・鳥類CTによるLLC-PK1細胞の形態異常誘導はadenylate cyclaseとC-kinaseの活性化を必要とすること、哺乳類CTはadenylate cyclaseは活性化するがC-kinaseを活性化する能力を持たないことが示唆された。 一方、confluentな状態のLLC-PK1細胞に対してeCTを作用させても形態変化は起こらないが、グルコース消費が昂進することが新たに確認された。この作用も魚類・鳥類CTで惹起されるが哺乳類CTや他のcAMP産生促進物質、8-Br-cAMPでは観察されなかった。PMAは単独でLLC-PK1細胞のグルコース消費を昂進し、またeCTによるグルコース消費昂進はC-kinase阻害剤のH-7で抑制された。この結果から魚類・鳥類CTによるLLC-PK1細胞のグルコース消費昂進はC-kinaseの活性化を介すること、哺乳動物CTはやはりC-kinaseを活性化しないとが示唆された。 従来、哺乳類CTより魚類・鳥類CTの方が哺乳動物でのin vivo活性が強い理由は、受容体に対する親和性の違いによるとされてきた。ところが本研究の結果から、活性化し得る細胞内情報伝達経路の違いが原因である可能性が示唆され、C-kinase活性化をも考慮に入れた、新しいCTのin vitro活性測定系の必要性が確認された。そこで、本研究で新たに見いだされたLLC-PK1細胞の形態変化誘導・増殖抑制作用とグルコース消費昂進作用のうち、より簡便かつ安価で再現性の良い、色素染色による増殖抑制作用の定量をCTの新規in vitro活性測定系として用いることにした。 これまでに、魚類CTを用いた研究から以下の知見が得られている。 1)8-22位は両親媒性a-helix構造をとる必要がある。 2)Lys11、Lys18をアセチル化すると活性が低下する。 3)cAMP産生に関与する部位は、CT分子の中央付近からN末端側にわたって存在する。 4)受容体結合に関与する部位は、CT分子のC末端付近に存在する。 本研究においては,活性発現に必須と考えられる残基を選択してこれを連続的にずらした位置に挿入する、新規な方法で誘導体をデザインした。活性発現に必要な配列中に挿入された場合は活性が低下すると予測されることから、その部位を特定することができる。この方法を以下に"挿入失活法"と呼ぶ。挿入失活法でデザインされたペプチドの長さ、アミノ酸組成は同一であるため、これらの因子の変化を除外することができる。本研究においては、最もin vivo活性が強いCTの一つであるeCTについて誘導体を合成し、その活性比較から構造活性相関を検討した。 ペプチド合成機を用いて固相法で合成した各誘導体は、LLC-PK1細胞での125I-eCTとの競合阻害を指標とした受容体結合、cAMP産生、及び新たに見いだした増殖阻害の各反応により活性を評価した。まず、Lys18を欠失した誘導体dKについて活性を調べたところ、各活性ともeCTに比べ、2-3 orderの低下が観察され、Lys18はeCTの活性発現に必須であることが確認された。次いで、Lys18を12位から32位にわたって移動挿入した20個の誘導体(以下、Lysを挿入した位置の番号でK12、K13、・・・・、K32と表す)を合成し、活性比較を行なった。その結果、K12からK16の誘導体は3つの活性すべてが著しく低下しており、K17からK24はeCTとほぼ同等の活性を保持していた。K25からK32は、cAMP産生活性は保持していたが、受容体結合活性、増殖阻害活性は低下した。活性発現に必要な配列中にLysが挿入された場合に活性が低下すると予測されることから、12位から16位は受容体結合とadenylate cyclase活性化に関与する部位、25位から32位は受容体結合と、恐らくC-kinaseの活性化に関与する部位であることが示唆された。 eCTの活性発現に必要と推察された上記二つの部位のうち、前半の12位〜16位は、従来両親媒性a-helix構造が必要とされてきた8位〜22位の範囲に含まれる。そこで次に、各誘導体の両親媒性a-helix構造と、活性との相関について検討を行なった。アミノ酸組成が同一であるペプチドは、両親媒性が高いほど逆相HPLCでのretention timeが遅いという報告がなされている。各ペプチドについて逆相HPLCでの挙動を検討したところ、K12〜K16は他のペプチドより著しく早く溶出され、両親媒性が低下していると判断された。Circular dichroism測定によりa-helix含量は低下していないことが確認されたことから、K12〜K16はa-helix構造は保持していたが両親媒性が成立していないと予測された。そこで各誘導体についてEdmundson helical wheel plotを行なったところ、8位から17位の範囲でplotした場合に両親媒性の成立と活性とがよく一致しており、これより長い範囲にわたってplotした場合には一致しなかった。従って、両親媒性a-helix構造をとることが必要な部位は、8位から17位までであることが明らかとなった。また最初に見たdKの活性は、3つの系すべてで低下していたが、18位は両親媒性a-helix構造が必要とされる範囲に含まれていないこと、及び本研究以前の知見を考慮すると、Lys18の正電荷が受容体結合及びadenylate cyclase活性化に必要であったと推察された。 LLC-PK1細胞を用いた一連の実験により、CTについて以下のことが明らかとなった。 1)魚類・鳥類CTは、増殖期のLLC-PK1細胞の特徴的形態異常を誘導し、増殖を阻害する。この反応はおそらくadenylate cyclaseとC-kinaseの活性化を必要とする。 2)魚類・鳥類CTは、confluentなLLC-PK1細胞のグルコース消費を昂進する。この反応はC-kinaseの活性化を介すると考えられる。 3)哺乳類CTは、LLC-PK1細胞においてadenylate cyclaseを活性化するが、C-kinaseを活性化しない。 4)eCTの8位〜17位は、両親媒性a-helix構造が活性発現に必要であり、Lys18と共に受容体結合とadenylate cyclase活性化に関与する部位と考えられる。 5)25位〜32位は、受容体結合と恐らくC-kinaseの活性化に関与する。 | |
| 審査要旨 | 本論文は培養細胞を用いたカルシトニンの活性評価系の確立と、この評価系を用いたカルシトニンの構造活性相関の検討より成り立つ。 カルシトニン(CT)は破骨細胞の骨リン酸カルシウム溶出促進反応を抑制するなどを通じてカルシウムを骨に貯蔵させる作用を有する。哺乳類に対して魚・鳥類型CTの作用がヒト型、ブタ型より強いことが明らかになっていたがその理由は不明であった。又よりくわしい構造活性相関の検討も、in vitro評価系が確立されていなかったためおくれていた。 腎、血球、癌など多種類の細胞株についてCTの作用を検討し、最終的にブタ腎尿細管上皮細胞株(LLC-PK1)を用いて短期作用としてcAMP産生を、長期作用として増殖期の細胞に対しての形態異常誘導、増殖阻害、コンフルエントた状態の細胞に対してのグルコース消費促進を測定する事でCTの生理活性を定量的、かつ簡便に評価する系を確立した。魚、鳥類型CTの一つであるウナギのCT(eCT)はcAMP産生亢進、形態異常誘導、細胞増殖阻害、グルコース消費促進いずれもの活性を示したが、哺乳類型CTはcAMP産生亢進しか示さなかった。グルコース消費の促進たどがPKC阻害剤H-7で阻害され、又PMAと8-Br-cAMPによってeCTの作用がミミックされる事からeCTの作用にはアデニレートサイクラーゼとPKCの活性化が介在する事が示唆された。哺乳類CTにはPKC活性化を誘導する能力がないと推定された。 eCTの構造をもとに、上記のような確立した評価系を用いて構造活性相関の検討を行たった。活性発現に必要と考えられるドメイン中の特定の残基を選択してこれを連続的にずらした位置にそう入するという新規な方法(挿入失活法と命名)によってLys18の位置をずらした誘導体を合成し活性を比較し、次の結論をえた。 (1)アミノ酸12位〜16位:受容体への結合、アデニレートサイクラーゼ活性化に関与する部位である。 (2)25位〜32位:受容体への結合、PKC活性化に関与する部位である。 (3)8位〜17位:両親媒性 (4)Lys18の正電荷が活性発現に必須である。 以上、本研究はこれまで定見がみられていなかったカルシトニンの作用および構造一活性相関について新たな知見を見出し、カルシトニンの臨床応用に有用な情報を提供したものであり、薬学の進歩に寄与するところがあり、博士(薬学)の学位に価すると判定された。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50882 |
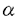 -ヘリックス構造形成に必要な部位である。
-ヘリックス構造形成に必要な部位である。