| 内容要旨 | | ケトン 位のアルキル化反応による不斉的炭素-炭素結合形成反応は、有機合成化学上極めて重要な研究課題の一つである。筆者はキラル二級アミンを外部配位子として用いた4-t-ブチルシクロヘキサノンのジアステレオ選択的アルキル化反応の検討により、シクロヘキサノン 位のアルキル化反応による不斉的炭素-炭素結合形成反応は、有機合成化学上極めて重要な研究課題の一つである。筆者はキラル二級アミンを外部配位子として用いた4-t-ブチルシクロヘキサノンのジアステレオ選択的アルキル化反応の検討により、シクロヘキサノン 位のエナンチオ選択的アルキル化反応の立体化学経路の解明に成功した。同時に、本反応が極めて高い光学活性を有する2,4-,2,5-,2,6-二置換シクロヘキサノンの立体選択的合成に有用な方法であることを見い出した。 位のエナンチオ選択的アルキル化反応の立体化学経路の解明に成功した。同時に、本反応が極めて高い光学活性を有する2,4-,2,5-,2,6-二置換シクロヘキサノンの立体選択的合成に有用な方法であることを見い出した。 Iエナンチオ選択的アルキル化反応の立体化学経路の検討 当研究室では既にシクロヘキサノンや -テトラロンのような環状ケトンの高エナンチオ選択的アルキル化反応を報告している。本不斉反応は対称な -テトラロンのような環状ケトンの高エナンチオ選択的アルキル化反応を報告している。本不斉反応は対称な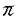 システムを有するアキラルなエノラートのエナンチオ面を区別するものであり、アルキル化剤の攻撃に対しキラルアミン・リチウムエノラート・LiBr錯体(4)が有効な不斉空間をつくり出し、高いエナンチオ選択性を与えたものと考えられる。一方、フレキシブルな六員環系(例えばこの場合、コンホマー(6)とコンホマー(7))における システムを有するアキラルなエノラートのエナンチオ面を区別するものであり、アルキル化剤の攻撃に対しキラルアミン・リチウムエノラート・LiBr錯体(4)が有効な不斉空間をつくり出し、高いエナンチオ選択性を与えたものと考えられる。一方、フレキシブルな六員環系(例えばこの場合、コンホマー(6)とコンホマー(7))における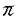 -面選択性に立体電子的効果が重要な役割を演ずることが知られている。そこで、この高立体選択的不斉アルキル化反応の立体化学経路には次のような疑問が生じてくる。 -面選択性に立体電子的効果が重要な役割を演ずることが知られている。そこで、この高立体選択的不斉アルキル化反応の立体化学経路には次のような疑問が生じてくる。 (1)キラル二級アミン((R)-1)は6と7の両方のコンホマーにおいて親電子剤の攻撃方向を規制しているのか? (2)キラルアミンは一方のコンホマーのみのアルキル化を促進し、結果として6と7の平衡により片方のコンホマーのみが親電子剤と反応しているのか? (3)錯体(4)のアルキル化において親電子剤はアキシアル攻撃をしているのか?それともエクアトリアル攻撃をしているのか(Scheme 1)?  筆者は本不斉アルキル化反応の立体化学経路を解明するために、立体的に嵩高いt-ブチル基がエクアトリアル位を占め、半いす配座で存在すると考えられる光学活性なリチウムエノラート9(R)及び9(S)のアルキル化反応の研究を設定した。 トルエン中、DME 8当量を用いてキラルアミン((R)-1)またはアキラルアミン(2)、及びLiBrの存在下、8のアルキル化反応を検討した。2の存在下、d1-8のベンジル化では、臭化ベンジルが9(R)及び9(S)に対しアキシアル攻撃した10と12が、エクアトリアル攻撃した11と13に対し2:1の比で優先的に得られた(Table 1,run 1)。一方、(R)-1を用いた場合には、10と13の優先的な生成が認められた(run2)。これを光学活性な8で確認したところ、(R)-8からは10が優先的に得られ、(S)-8からは13が優先的に得られた(run 3,4)。   Table 1. Table 1. これは(R)-1の影響下、R配置の9に対してはアルキル化剤のアキシアル攻撃が高い選択性で優先した(ax-attack:eq-attack=24:1)のに対し、S配置の9に対してはエクアトリアル攻撃が優先した(ax-attack:eq-attack=1:9)ことを意味する(Table 2)。すなわち、このジアステレオ面選択性の促進及び逆転は、(R)-1の影響が立体電子的効果を凌駕していることを示すものである。8のメチル化の結果もベンジル化と同様な立体化学的な傾向を示した。  Table 2. Table 2. 本研究結果より、シクロヘキサノンのエナンチオ選択的なアルキル化反応の立体化学経路については、キラルアミン((R)-1)が6及び7の両方のコンホマーに対し高度に親電子剤の攻撃方向を規制し、その結果、高いエナンチオ選択性が実現したものと考えられる。 II光学活性二置換シクロヘキサノン類の立体選択的合成 筆者は、不斉アルキル化反応における立体化学経路の研究において、キラルアミン((R)-1)が親電子剤のアキシアル及びエクアトリアルの攻撃方向を任意に制御できることを見い出しており、基質として光学活性な一置換シクロヘキサノンのシリルエノールエーテルを用いるならば、本ジアステレオ選択的不斉アルキル化反応により極めて光学純度の高い二置換シクロヘキサノンの立体選択的合成が期待できると考えた。そこで、本法を2,4-,2,5-,及び2,6-二置換シクロヘキサノンの光学活性体の合成へ展開した。 1.2,4-二置換シクロヘキサノンの不斉合成(Table 1参照) (R)-1の存在下、(R)-8のベンジル化では98%e.e.のトランス体(10)が高いジアステレオ選択性で得られた(run 3)。一方、(S)-8からは99%e.e.のシス体(13)が優先的に得られた(run 4)。また、8のメチル化もベンジル化の場合と同様な傾向を示し、(R)-8からは98%e.e.のトランス体(14)が(run 7)、(S)-8からは98%e.e.のシス体(17)が優先的に得られた(run 8)。 2.2,5-二置換シクロヘキサノンのジアステレオ選択的合成 (R)-1の存在下では、極めて高いジアステレオ選択性でシス体(19)が優先的に得られた。一方、(S)-1の存在下では、トランス体(20)が優先的に得られた。すなわち、本反応例はR,Sいずれかのキラルアミンを選択することにより、目的とする絶対配置をもつ両光学活性体を、高い選択性でつくり分けることができることを示したものである。  3.2,6-二置換シクロヘキサノンの不斉合成 最初に(R)-21のベンジル化を行った(Scheme 3)。(R)-1の存在下では、99%e.e.のトランス体(22)が高いジアステレオ選択性で得られた。 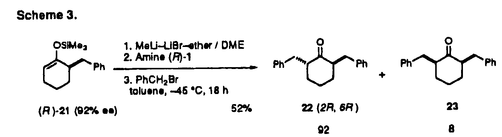 次に(R)-21のメチル化を行った(Scheme 4)。(R)-1の存在下では、99%e.e.のトランス体(24)が優先的に得られた。  最後にラセミの28のベンジル化を行った(Scheme 5)。(R)-1の存在下では、臭化ベンジルがアキシアル攻撃した24とエクアトリアル攻撃した25が優先的に得られた。この中で25は99%e.e.の極めて高い光学純度を有し、本反応の高い有用性が認められた。  ここで得られた光学活性二置換シクロヘキサノンは全て単離され、例えば2,4-二置換体10(Table 1,run 3)は単離収率65%で得られた。また、本法で用いたキラルアミンは光学純度を損なうことなくほぼ定量的に回収され再使用が可能であった。 以上のことより本反応は、キラルアミン1(R,S)を使い分けることにより、高度に親電子剤のアキシアル及びエクアトリアルの攻撃方向を規制し、極めて高い光学活性を有する2,4-,2,5-,2,6-二置換シクロヘキサノンの異性体全てを、絶対配置を予測して合成できる立体選択的アルキル化反応の開発に初めて成功したことを意味する。 |
| 審査要旨 | | ケトン 位の不斉アルキル化反応は、有機合成化学における極めて重要な反応である。すでに、四配座型キラルアミン(1)を不斉源に用いたシクロヘキサノンや 位の不斉アルキル化反応は、有機合成化学における極めて重要な反応である。すでに、四配座型キラルアミン(1)を不斉源に用いたシクロヘキサノンや -テトラロン等の環状ケトンのエナンチオ選択的不斉アルキル化反応が報告されている。本研究は、この不斉反応の立体化学を明らかにすると共に、その結果を用いて2,4-、2,5-、2,6-ジ置換シクロヘキサノン類の両ジアステレオマーを高い光学純度で合成する方法を開拓したものである。 -テトラロン等の環状ケトンのエナンチオ選択的不斉アルキル化反応が報告されている。本研究は、この不斉反応の立体化学を明らかにすると共に、その結果を用いて2,4-、2,5-、2,6-ジ置換シクロヘキサノン類の両ジアステレオマーを高い光学純度で合成する方法を開拓したものである。 シクロヘキサノンから得られるシリルエノールエーテル(3)をMeLi-LiBr錯体で処理してLiBrを含むリチウムエノラート(4)とし、(R)-1の存在下にベンジル化すると、5が92%eeで得られる。4には6と7の二つのコンホーマーが存在すると筈であり、通常アルキル化はアキシアル攻撃生成物が優先するという立体電子効果が知られているから、上記の高い立体選択性が得られる事実には、何等かの理由がなければならない。 4-tert-ブチルシクロヘキサノンから得られるシリルエノールエーテルのエナンチオマーは、6あるいは7のコンホメーションをとっていると考えられる。既知の方法によってこれらを高い光学純度で合成し、それらを上記と同様の方法でベンジル化およびメチル化を行い、それらの立体化学を調べた。その結果、アキラルアミン(2)を用いた場合には定説通りの立体電子効果が認められたが、キラルアミン((R)-1)を用いた場合には、反応の立体化学は用いたキラルアミンによって強く支配され、その効果は上記の立体電子効果を凌駕することを見出した。このことは、1の両対称体を使い分けることによって、6あるいは7のコンホメーションをとったリチウムエノラートのアキシアルあるいはエクアトリアルのいずれの方向からも、選択的にアルキル化し得る方法を見出したことになる。  図表 図表 この手法を用いて、2,4-ジ置換シクロヘキサノン類は4-置換シクロヘキサノン類のキラル塩基による不斉脱プロトン化反応と組み合わせて、2,6-ジ置換シクロヘキサノン類はシクロヘキサノンの不斉アルキル化反応を二回行って、また、2,5-ジ置換シクロヘキサノン類は市販の光学活性3-置換シクロヘキサノンを原料にして、それぞれの両ジアステレオマーを高い光学純度で合成できることを実証した。 以上本研究は、四配座型キラルアミンを不斉源として、環状ケトンの 位の不斉アルキル化反応の立体化学を任意に制御する方法を開拓したもので、有機合成化学に寄与するものであり、博士(薬学)の学位に値する論文であると認めた。 位の不斉アルキル化反応の立体化学を任意に制御する方法を開拓したもので、有機合成化学に寄与するものであり、博士(薬学)の学位に値する論文であると認めた。 |