| 内容要旨 | | pSC101は全長9.2Kbのプラスミドであり、宿主大腸菌の染色体あたり約5コピー存在する。pSC101の複製には宿主の蛋白に加え自己のゲノムにコードする分子量37K daltonのRep蛋白を必要とし、rep遺伝子を含む1.3Kbの領域があれば自律複製することができる。複製開始領域(ori領域:約220bp)の特徴としては21bpからなるdirect repeatが3個(DR-1,2,3)、direct repeatと相同性の高いinverted repeatが2個(IR-1,2)存在する。複製開始領域の構造を図1に示した。このori領域内に存在する約20bpのdirect repeatはiteronと総称され、ori領域内にiteronを持つ複製系は原核生物から真核生物まで広く見いだされている。Rep蛋白はDR,IR-1,IR-2の三ヶ所に結合するが、DRに対してはイニシエーターとして、IR-1に対しては複製開始の頻度を上昇させるエンハンサーとして、さらにIR-2に対してはリプレッサーとして働き、まったく異なった機能を発揮する。本研究ではイニシエーターであるRep蛋白が複数の塩基配列を認識して生物学的に異なった機能を発揮する機構を分子レベルで明らかにすることを目的とし、解析を行った。 1.iteronの下流領域の必要性 pSC101同様ori領域内にiteronを持つプラスミドについても精力的に研究が行われているが、iteronの下流の領域が複製に必要である例はpSC101以外には現在のところ見つかっていない。そこでoriの末端に位置するDR-3の下流領域(IR-1を含む約50bp)の機能を探るため、position415〜426の12bpについて一塩基だけ他の塩基に置換させた36種のpoint mutationを作製し、複製能(Ori活性)を調べた。変異導入部位を図1に示す。その結果、わずか一塩基置換でOri活性が著しく低下したものが得られ、置換によって影響をうけたのはposition 420〜422のCACに限られていた。しかも、置換する塩基によってOri活性への影響の度合が異なった。この変異はRep蛋白の変異株でsuppressされたことから、position420〜422のCACとRep蛋白はDNA複製の際に相互作用する可能性が考えられる。 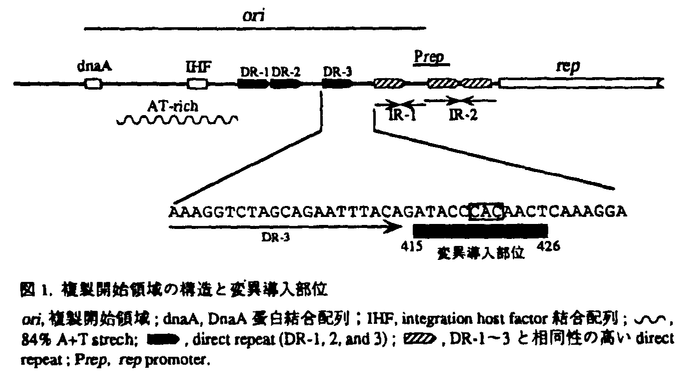 図1.複製開始領域の構造と変異導入部位ori,複製開始領域;dnaA,DnaA蛋白結合配列;IHF,integration host factor結合配列; 図1.複製開始領域の構造と変異導入部位ori,複製開始領域;dnaA,DnaA蛋白結合配列;IHF,integration host factor結合配列; ,84% A+T strech; ,84% A+T strech; ,direct repear(DR-1,2,and 3); ,direct repear(DR-1,2,and 3); ,DR-1〜3と相同性の高いdirect repeat;Prep,rep promoter.2.Rep蛋白の精製とDNA結合活性A.Rep蛋白の精製 ,DR-1〜3と相同性の高いdirect repeat;Prep,rep promoter.2.Rep蛋白の精製とDNA結合活性A.Rep蛋白の精製 pSC101のDNA複製に重要な役割を発揮するRep蛋白の機能を調べるため精製を行った。最終標品のアミノ末端側26残基は最初のメチオニンがない以外はDNA sequenceから予想されるものと一致したことから、精製した標品はRep蛋白であると結論した。グリセロール密度勾配遠心法およびゲルろ過カラムクロマトグラフィーの結果からRep蛋白は二量体であることが分かった。 B.Rep蛋白のDNA結合活性 ori領域とRep蛋白の相互作用についてDNase I footprintおよびExo III digestion実験を行った結果、Rep蛋白はまずIR-2に結合した後IR-1に結合し、DRにはIRの数十倍の濃度でないと結合は見られなかった。ゲルシフトアッセイの結果からRep蛋白二量体のKdappはIR-1が3nM,IR-2が2nMであった。一アミノ酸が変化することでpSC101のコピー数が約五倍上昇した変異型Rep蛋白をすでに単離していることから、これら変異型Rep蛋白(Rep1,Rep21)についても精製し同様の実験を行ったが、IRと同様の効率でDRに結合するものはなかった。 3.Rep蛋白のDNA結合モチーフ DR配列とIR配列は相同性が高いにもかかわらず、Rep蛋白二量体はIRにのみ効率よく結合する。また図2に示すようにIR-1,IR-2ともに完全なinverted repeatではない上に、塩基配列も異なる部分があることから、Rep蛋白のDNA結合モチーフを検討した。各half repeatは自己分子内で部分的にinverted repeatになっているため、head to tail(h-t:→→),head to head(h-h:→←),tail to tail(t-t:←→)と配置を変えても三者間で塩基配列が似かよる。従って、IRを構成する四種類のhalf repeat(1L,1R,2L,2R)およびDRがh-t,h-h,t-tに配置したDNAを系統的に合成し、各配列との結合能を調べることでRep蛋白のDNA結合モチーフを検討した。Rep蛋白と効率よく結合した配列の共通性からpseudo-symmetricな5’GGNNTAGNNATTNNNATNN(N)CTAGNCC3’が結合モチーフであると推測できた。これを検証するため、一〜三塩基だけ結合モチーフと異なり結合能が低い四種の配列について、結合モチーフと一致するよう一塩基置換したところ、いずれも結合能が大幅に上昇した。以上のことからRep蛋白二量体のDNA結合モチーフはpseudo-symmetricな5’GGNNTAGNNATTNNNATNN(N)CTAGNCC3’であると結論した。 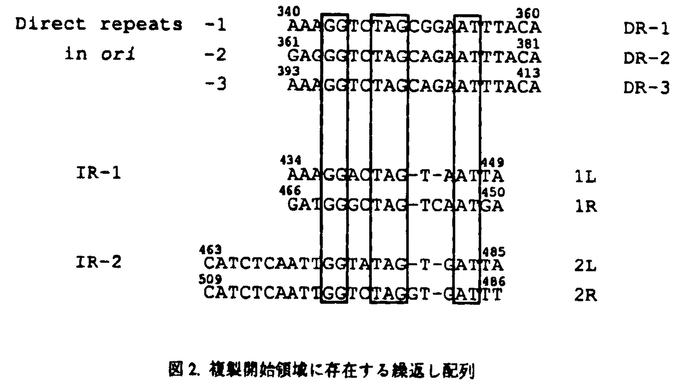 図2.複製開始領域に存在する繰返し配列4.グアニジン処理したRep蛋白のDR配列への結合 図2.複製開始領域に存在する繰返し配列4.グアニジン処理したRep蛋白のDR配列への結合 Rep蛋白二量体はリプレッサー活性を持つがDR配列に結合しにくいことから、イニシエーターは単量体である可能性が考えられる。事実、P1やmini-Fプラスミドでは単量体がイニシエーターであり、二量体から単量体への変換をシャペロンであるDnaK,DnaJが行うことが最近明らかとなってきた。そこでRep蛋白をまず強力な変性剤である塩酸グアニジンで処理し、DR配列への結合に変化が見られるか調べた。その結果6M塩酸グアニジン処理するとDR配列へ効率よく結合するようになった。しかもその結合はIR配列で阻害されなかった。次に、二個のDR配列がhead to tailに並んだDR(h-t)及びhead to headのDR(h-h)をプローブにゲルシフトアッセイを行ったところ、いずれの場合も二段階のシフトが見られRep量が増加すると高分子側にバンドが現れた。この結合はDR配列でのみ阻害され、DR配列の量が増加するに従って高分子側のバンドから消失するが、IR配列では変化が見られなかった。以上のことからDR配列に特異的に結合するのは単量体であり、単量体と二量体では認識配列が異なることが強く示唆された。 5.Rep蛋白のDR配列への結合に対するGroE蛋白の影響 DNA複製の制御を考える上で、in vivoにおいてRep蛋白の単量体と二量体間の変換を何が行っているのか非常に重要な問題である。そこでシャペロンのRep蛋白の構造変換への関与を検討した。大腸菌のシャペロンとしては主にDnaK,DnaJ,GrpEの三者とGroE(GroEL14量体とGroES7量体からなる複合体)の二つのグループがよく知られていることから、これらについて調べた。DnaK,DnaJ,GrpEではRep蛋白のDR配列への結合に変化は見られなかったが、GroEとRep蛋白二量体を反応させると効率は悪いもののDR配列への結合が上昇した。P1やmini-Fプラスミドでは DnaK,DnaJによって効率よく変換されるのに比べ、pSC101の場合GroEによる変換の効率は悪い。そこで二量体から単量体に変換するのではなく単量体を安定化するのではないかと考え、DR結合活性のGroEによる安定化を調べた。グアニジン処理したRep蛋白は25℃において半減期約10分でDR結合活性が減少する。そこでグアニジン処理後GroELを加えたところ、経時的なDR結合活性の減少は見られなくなった。ただし、GroESも作用させないと効率のよいDR結合活性は見られないことから、Rep-GroEL複合体からのRep蛋白の遊離にはGroESが必要であると思われる。また、この反応にはATPの加水分解が必要でありATPのアナログでは反応が見られなかった。 総括 本研究で明らかにしたことをまとめると 1.pSC101はori領域内にiteronを持つ一群のプラスミドの中で唯一iteronの下流の領域を必要とするが、わずか一塩基置換でOri活性が著しく低下したOri変異株を複数単離することでこの領域の重要性を確かめることができた。しかもこの変異はRep蛋白の変異株でsuppressされたことからDNA複製の制御を考える上でpSC101は非常に興味ある対象であると言える。 2.現在まで多数のプラスミドでイニシエーター蛋白の性質が調べられているが、DNA結合モチーフについて明確にされたものはなく、pSC101のものが初めてである。しかも二量体であるにもかかわらず、pseudo-symmetricな配列を認識するという特徴あるものであった。 3.グアニジン処理したRepとDNA複合体の挙動からイニシエーターとしてDRに特異的に結合するのは単量体であることが強く示唆された。さらにin vitroにおいてRep単量体の安定化にGroEが関与することを明らかにすることができた。これはGroEがイニシエーターの構造と機能の変換に働くことを示した最初の例であり、二量体から単量体に変換するのではなく単量体を安定化するという点でもユニークである。 pSC101は他のプラスミドと比較して様々な点でユニークであり、今後さらに研究することでDNA複製開始の分子機構の解明に貢献できるものと信じる。 |
| 審査要旨 | | この研究は、pSC101というバクテリアのプラスミドの複製機構に関して、以下のような新しい事実を記載したものである。pSC101は宿主大腸菌の染色体当たり約5コピー存在する、全長9.2kbのプラスミドである。 (1)このプラスミドの複製は、複製開始領域(ori)内にあるiteronと総称される3個のdirect repeat(DR、約20bp)とその配列と相同性の高い2個のinverted repeat(IR)およびRep蛋白と呼ばれる複製開始蛋白によって制御されていることが示されている。Rep蛋白をコードするrep遺伝子はプラスミド上にあり、複製開始はori領域とrep遺伝子があれば進行する。 この研究では、新しくori領域内のiteronの下流領域が複製に必要であることを見出した。そして、この領域の種々の変異株を作製した結果、420-422番目に存在するCACという配列が重要で、この部分が1塩基置換しただけで複製活性は著しく低下することを認めた。また、この変異はRep蛋白の変異株でsuppressされることから、この新しく見出した領域とRep蛋白が相互作用する可能性が指摘できた。 (2)ついで、Rep蛋白を始めて精製し、この蛋白が2量体として機能することを明らかにした。また、精製したRep蛋白とDR、IRとの親和性、結合特異性を検討し、各々に対するKd値を記載した。 (3)グアニジン処理したRep蛋白とDNA複合体の挙動から、Rep蛋白がイニシエーターとしてDRに結合する時には、単量体であることが示唆された。一方、精製したRep蛋白は2量体であることから、バクテリアの細胞内に単量体から2量体に移行する過程を制御している機構があると考えられ、in vitroで種々検討した結果、HSPの一種であるGroEに単量体を安定化する働きがあることを見出した。おそらく、Rep蛋白のコンフォーメイションの変換は、GroEによって制御されているものと思われる。 以上この研究は、pSC101のようなori領域内にiteronを持つプラスミドの複製機構に新しい知見を加えたもので、微生物学、分子生物学の進展に寄与するものであり、博士(薬学)の学位に値するものと判断した。 |