Pituitary adenylate cyclase activating polypeptide(PACAP)は、1989年、Miyataらによってヒツジ視床下部より単離されたvasoactive intestinal polypeptide(VIP)様のペプチドである。現在、38アミノ酸残基から成るPACAP38と27アミノ酸残基から成るPACAP27の二種が知られている。両ペプチド共、ラット下垂体のcAMPを増加させるが、その力価はVIPの1000倍であるという。PACAPおよびその結合部位は中枢神経系に多く存在することが報告されており、この内在性ペプチドが神経伝達物質/神経調節因子として働いている可能性が考えられるが、脳での生理学的役割は全く分かっていない。PACAP研究のこのような立ち遅れの理由としては、本ペプチドとその結合部位の分布に関する知見が蓄積されていないことが挙げられる。 我々は、先ず神経伝達物質の同定基準の一つである「局在」を調べる必要があると考え、ラット脳の微細解剖とモノクローナル抗体を用いたサンドイッチ-酵素免疫法(EIA)を行った。PACAP含量が多い部位について、その抽出試料を逆相HPLCにかけ各分画についてPACAP38およびPACAP27を定量したところ、脳内に存在するPACAPの大部分はPACAP38であることが明かになった。したがって、ラット中枢神経系62部位をパンチアウトし、PACAP38の含量を測定した。その結果、内因性のPACAP38量は部位によって大きな差があることが分かった。PACAP38が最も多かったのは視床下部であり、既報の知見と一致するものであったが、本研究では、さらに詳細な局在を調べた。測定した視床下部の7部位の内、最も高レベルを示したのは視交叉上核であった。その他の部位では、外側中隔核(内側部)、対角帯、扁桃体中心核、中心灰白質、脚間核、背側縫線核における含量が高かった。これらの結果は、本ペプチドと神経伝達物質、例えばアセチルコリン(ACh)、カテコールアミン、セロトニンとの相互作用の可能性を示唆するものである。さらに、本研究において観察されたPACAPの局在は、過去に報告されているVIPの局在とも異なっていた。本結果により、PACAPが中枢神経系においてVIPとは異なった神経伝達物質あるいは神経調節因子としての役割を果たしている可能性が考えられる。 第二に、中枢神経系におけるPACAP結合部位を調べた。初めに、ラット脳切片(海馬背側部を含むレベル)における[125I]PACAP結合部位と[125I]VIP結合部位のキャラクタライゼーションを行った。[125I]PACAP27結合はPACAP38、PACAP27によって阻害されたがVIPによってほとんど阻害されず、[125I]VIP結合はVIP、PACAP38、PACAP27のいずれによっても阻害された。[125I]PACAP27(0.1nM)結合の非標識PACAP38、PACAP27による置換曲線は、IC50:それぞれ13.8、24.2nMを示し、[125I]VIP(0.1nM)結合の非標識VIP、PACAP38、PACAP27による置換曲線は、IC50:それぞれ4.4nM、2.9nM、6.0nMを示した。したがって、脳におけるPACAP結合部位には、PACAP特異結合部位とVIP/PACAP結合部位の二種が存するものと考えられる。しかしながら、脳におけるPACAP結合部位の大部分はPACAP特異結合部位であることも分かった。次に、PACAPおよびVIPの結合実験を同じ条件下で行い、オートラジオグラムをとってそれぞれの結合部位の脳内分布を比較した。VIP結合部位の密度および局在パターンは既報のものとほぼ同じであった。PACAP結合部位密度は、調べた全ての部位においてVIP結合部位密度より高かった(4-21倍)。また、PACAP結合部位の局在はVIP結合部位とは異なるパターンを示すことが分かった。PACAP結合部位は全脳において高密度であったが、特に梨状葉皮質、対角帯、側坐核、線条体吻側部、海馬体、手綱核、視床正中中心核、視床下部外側野、上丘、背側縫線核等で高く、海馬体においては明確な局在が観察された。これらの結果は、ACh、カテコールアミン、セロトニン等との相互作用を示唆するものである。本研究データ、および、PACAPが下垂体細胞やPC12h細胞のアデニル酸シクラーゼを活性化する力価がVIPより1000倍強いという事実を考え合わせると、PACAPが中枢神経系の調節においてVIPとは異なった重要な役割を有している可能性が考えられる。これまで、脳におけるPACAPの役割に関する研究は報告されていないが、脳諸部位におけるPACAPの生理学的研究は興味深いものであると考える。 以上の研究によって、成熟ラット脳における内因性PACAPとその結合部位の局在が明らかになったが、PACAPが脳の発達段階で重要な役割を有するものであるかどうかは全く分かっていない。そこで、第三に、生後間もない段階からの内因性PACAP含量およびPACAP結合部位密度の変化を調べた。生後2、4、8、12、20、30、60、100、240日目にラットを断頭し、同一の脳から300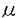 mおよび20 mおよび20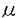 m厚の凍結切片を作製した。300 m厚の凍結切片を作製した。300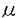 m厚の切片からは8領域をパンチアウトしてサンドイッチ-EIAでPACAP38の含量を測定し、20 m厚の切片からは8領域をパンチアウトしてサンドイッチ-EIAでPACAP38の含量を測定し、20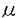 m厚の切片はPACAP結合部位のオートラジオグラフィーに用いた。その結果、内因性PACAP含量は生後早い時期には低レベルであり、30-60日程でピークに達した。その後は、ほとんどの領域で、本ペプチドのレベルは240日目まで安定であった。この生後変化は、VIP含量や古典的神経伝達物質の含量における変化と類似していた。本結果は、成熟ラット脳におけるPACAP様免疫反応が神経細胞に認められるというデータを考え合わせると、PACAP含有神経が他の神経同様、生後に発達するということを示唆するものである。また、PACAPが生後に生じる神経発達の段階で重要な役割を担っている可能性が考えられる。一方、PACAP結合部位密度は、生後2日目において既に成熟ラットと同程度の高密度を示した。その後、多くの領域では一過性に密度が低下し、再び増加して30-60日程度でピークに達することが明らかになった。ピーク後は240日目まで顕著な変化は認められなかった。したがって、PACAP受容体は胎仔期には既にその発現量が多いこと、および生後も神経が発達し成熟する頃にも発現の重要な増加があり、ピークに達することが考えられる。PACAP結合部位はアストロサイトにも存在することが示唆されているので、胎仔期にはグリア細胞上のPACAP受容体が増加し、生後はニューロン上のPACAP受容体が増えると考えることが出来る。本研究結果は、PACAPが神経伝達物質として働いている可能性、および中枢神経系の発達に重要な役割を果たしている可能性を示唆するものである。 m厚の切片はPACAP結合部位のオートラジオグラフィーに用いた。その結果、内因性PACAP含量は生後早い時期には低レベルであり、30-60日程でピークに達した。その後は、ほとんどの領域で、本ペプチドのレベルは240日目まで安定であった。この生後変化は、VIP含量や古典的神経伝達物質の含量における変化と類似していた。本結果は、成熟ラット脳におけるPACAP様免疫反応が神経細胞に認められるというデータを考え合わせると、PACAP含有神経が他の神経同様、生後に発達するということを示唆するものである。また、PACAPが生後に生じる神経発達の段階で重要な役割を担っている可能性が考えられる。一方、PACAP結合部位密度は、生後2日目において既に成熟ラットと同程度の高密度を示した。その後、多くの領域では一過性に密度が低下し、再び増加して30-60日程度でピークに達することが明らかになった。ピーク後は240日目まで顕著な変化は認められなかった。したがって、PACAP受容体は胎仔期には既にその発現量が多いこと、および生後も神経が発達し成熟する頃にも発現の重要な増加があり、ピークに達することが考えられる。PACAP結合部位はアストロサイトにも存在することが示唆されているので、胎仔期にはグリア細胞上のPACAP受容体が増加し、生後はニューロン上のPACAP受容体が増えると考えることが出来る。本研究結果は、PACAPが神経伝達物質として働いている可能性、および中枢神経系の発達に重要な役割を果たしている可能性を示唆するものである。 最後に、これまでの結果を踏まえてPACAPの生理学的役割を調べることにした。いろいろな神経伝達物質との相互作用の可能性が考えられたが、本研究では、PACAP結合部位が特に高密度であり、記憶、学習に重要な役割を果たしていると考えられている海馬のコリナージックニューロンに注目した。そして、PACAPならびにVIPがラット海馬からの自発的ACh放出に及ぼす影響を調べた。我々は、マイクロダイアリシスを用い、無拘束ラットの海馬背側部からのACh放出量を検出し得た。海馬への12-120pmol VIP、PACAP38、PACAP27(10-6-10-5M溶液を0.8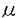 l/分で15分間)の注入は、AChの自発的放出量を用量依存的に有意に増加させた。ACh放出を上昇させる力価は、VIP>PACAP38>PACAP27の順であった。120pmol VIP、PACAP38、PACAP27によってACh放出量が増加したとき、テトロドトキシン(TTX)(10-5M)を潅流液に加えたところ、ペプチドによって上昇したACh放出のみならず基礎遊離レベルも有意に低下した。この結果は、本研究において検出したACh放出が、中隔-海馬系コリナージックニューロンの神経終末における神経伝達を反映したものであることを強く示唆するものである。また、ペプチドによるACh放出の増加は、カルシウム依存的であることが分かった。本研究は、VIP、PACAPがラット海馬背側部のACh神経終末にプレシナプス性に影響を及ぼすことをin vivoで証明した最初の例である。これらのペプチドは海馬背側部におけるACh神経伝達をプレシナプス性に賦活するものであると考えられる。また、ACh神経終末におけるACh貯蔵量を保持するためにACh合成(カルシウム依存的)を促進するものであると考える。 l/分で15分間)の注入は、AChの自発的放出量を用量依存的に有意に増加させた。ACh放出を上昇させる力価は、VIP>PACAP38>PACAP27の順であった。120pmol VIP、PACAP38、PACAP27によってACh放出量が増加したとき、テトロドトキシン(TTX)(10-5M)を潅流液に加えたところ、ペプチドによって上昇したACh放出のみならず基礎遊離レベルも有意に低下した。この結果は、本研究において検出したACh放出が、中隔-海馬系コリナージックニューロンの神経終末における神経伝達を反映したものであることを強く示唆するものである。また、ペプチドによるACh放出の増加は、カルシウム依存的であることが分かった。本研究は、VIP、PACAPがラット海馬背側部のACh神経終末にプレシナプス性に影響を及ぼすことをin vivoで証明した最初の例である。これらのペプチドは海馬背側部におけるACh神経伝達をプレシナプス性に賦活するものであると考えられる。また、ACh神経終末におけるACh貯蔵量を保持するためにACh合成(カルシウム依存的)を促進するものであると考える。 本研究は、ラット中枢神経系における内因性PACAPおよびその結合部位の局在がVIPとその結合部位の分布とは異なることを明らかにした。PACAP結合部位はVIP結合部位よりはるかに高密度であることも分かり、PACAPが生理学的に重要な役割を果たしている可能性が示唆された。PACAP含量の生後変化はPACAP含有神経の存在を強く支持したが、その結合部位密度の生後変化は、結合部位が神経のみならず非神経上にも存在することを示唆した。最後に、PACAPが海馬からの自発的ACh放出を促進することを見いだしたが、その効果はVIPより若干弱いものであった。今後、VIPより力価が強い生理作用を突き止め、中枢神経系におけるPACAPの生理学的役割を解き明かしていくことは重要な課題であると考える。 |