1型糖尿病は、若年発症型であり、欧米では全糖尿病患者の一割程度を占める難病である。自己免疫疾患と考えられており、膵ランゲルハンス島(以下ラ島)細胞を特異的に攻撃するリンパ球(主としてTリンパ球)が中心的役割を演ずる免疫反応により、膵ラ島細胞が破壊され、インスリン産生が障害されることにより発症する。1型糖尿病の根治療法として、膵移植および膵ラ島細胞移植が注目されている。しかしながら、免疫抑制剤を長期間服用しなければならず、副作用も無視できない。BBラットは、NODマウス同様、インスリン依存型糖尿病の動物モデルである。BBラットにおける実験で、糖尿病発症機序は骨髄前駆細胞の非T細胞分画の異常に原因があると報告されている。また、NODマウスを用いた実験で、骨髄細胞レベルに於ける機能不全が糖尿病発症にかかわっているとの報告がある。即ち、抗原呈示細胞の異常により、胸線における抗原呈示が適切に行なわれていない可能性が示唆される。 最近Posseltらは、ラットを用いた胸腺内膵ラ島細胞移植実験で、以下のように報告している。異なった系のラットから分離採取した膵ラ島細胞を、マウス抗ラットリンパ球免疫グロブリン(ALS)の投与下に胸腺内に移植すると、免疫抑制剤なしで長期間生着するだけでなく、続いて同系ドナーのラ島を腎被膜下に移植すると、免疫抑制剤なしで受容される。 そこで我々は、新生児期のNODマウスの胸腺内に、NODマウス由来の膵ラ島細胞を移植してやれば、生後5-6週で観察される膵ラ島炎、ひいては糖尿病発症をも抑制しうるという可能性に着目し、以下の実験を行なった。 方法 胸腺内ラ島細胞移植群の作成 胸腺内移植に用いた膵ラ島細胞は、生後5日以内の新生児マウスの膵を用いた。摘出した膵を、コラゲナーゼによる消化の後、5-7日間37℃で培養し、これを生後10-11日の雌のNODマウスの胸腺内に移植した(n=32)。また、コントロール群として、Phosphate buffered saline(PBS)溶液のみを胸腺内に注入した(n=32)。 糖尿病発症のモニター方法 実験に用いたNOD/Ymコロニーでは、生後30週における糖尿病発症率は雄で30%、雌で70%に達する。レシピエントは第12週より血糖、尿糖、体重を定期的にモニターし、これを30週に達するまで、又は糖尿病を発症するまで続けた。尿糖1+以上を糖尿病とし、血糖値が300mg/dl以上であることを確認した。 ラ島炎の評価 30週に達したマウスは犠牲死させ、胸腺内ラ島細胞、及び膵内ラ島細胞を病理学的に検索した(実験群:n=8、コントロール群:n=10)。一方、コントロール群で、20-29週で糖尿病を発症したマウスも検討の対象とした(n=6)。膵臓は尾部を切除し、10%ホルマリンにて固定した後、ヘマトキシリン-エオジン(HE)染色標本を作成し、光顕下にラ島細胞を観察すると共に、ラ島細胞数を同定した。胸腺内ラ島細胞は、HE染色標本に加えて抗インスリン抗体を用いたインスリン染色標本を作成した。ラ島炎の程度の判定には、Wickerらの基準を用いた.即ち、Score0:ラ島炎を認めない、1:リンパ球浸潤は膵管および血管周囲に限局している、2:リンパ球浸潤はラ島周囲に限局しており、ラ島内には及んでいない、3:リンパ球浸潤はラ島内に及んでいる、との定義を用いた。 胸腺内肝細胞移植群の作成 胸腺内ラ島細胞移植による自己免疫反応の抑制現象は、ラ島細胞表面抗原に特異的な反応であることが予想される。これを確認するために、NODマウスの胸腺内に、新生児NODマウスより分離、培養した肝細胞を移植した(n=7)。生後12週で全例犠牲死させ、膵尾部より組織切片を作成、前述と同様の方法でラ島炎の程度を検索し、同週令の胸腺内ラ島細胞移植群(n=4)と比較した。 脾臓内Tリンパ球ナブセットの検索 レシピエントの脾臓より採取したリンパ球を、Cytosp inを用いてスライドグラスに吹き付け、固定した後に免疫染色を行なった。抗体はLyt-2、L3T4、Thy1、2を用いた。光顕下に200個のリンパ球を数え、それぞれの抗体で染色された細胞の割合を計算した。 Cyclophosphamide(CP)投与の糖尿病発症及びラ島炎に及ぼす影響 30週にて糖尿病を発症しなかったNODマウスを、実験群よりn=15、コントロール群よりn=12抽出した。実験群のマウスをさらにCP投与群9例、生食注入群6例の2群に分けた。CPは150mg/kgを2週間の間隔をおき、2回投与した。糖尿病発症のモニター及び組織学的検索の方法は、先に述べた方法に準じた。 結果 糖尿病発症率の比較 両群における糖尿病発症頻度は、実験群で2/32(6.3%)、対照群で10/32(31.3%)と、実験群で有意に低値を示した(p<0.05)。 胸腺内移植ラ島細胞の組織学的検索 胸腺内に移植されたラ島細胞は、自己免疫機序によるリンパ球浸潤も認められず、よく保たれていた。抗インスリン抗体による染色にて、インスリン産生が確認された。 ラ島炎の程度による分析 実験群では、ラ島炎が著明に抑制されており、ラ島炎の認められない正常な膵ラ島数が有意に多く保たれていた(表1)(p<0.001)。 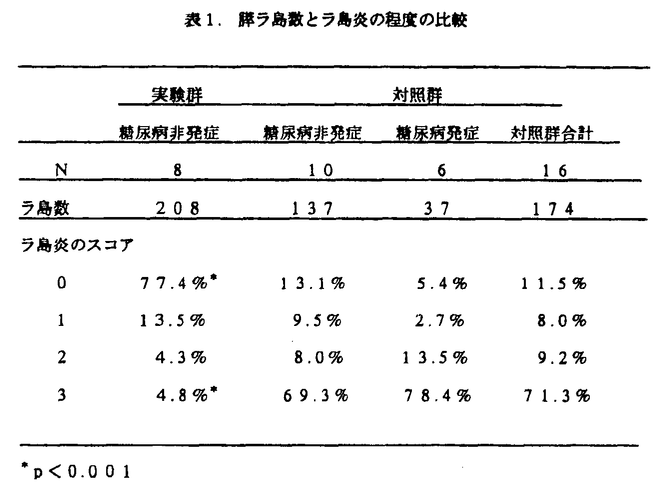 表1.膵ラ島数とラ島炎の程度の比較 表1.膵ラ島数とラ島炎の程度の比較 胸腺内肝細胞注入群におけるラ島炎の程度 肝細胞を胸腺内に移植し、12週経過したNODマウスの膵ランゲルハンス島を調べてみると、67%のラ島にリンパ球浸潤、即ちラ島炎の所見を認めた。一方、12週令の胸腺内ラ島細胞移植群マウスでは、31%のラ島にラ島炎を認めるのみであった(p<0.01)。即ち、胸腺内に肝細胞を移植したNODマウスでは、ラ島炎の発症は抑制されなかった。 Tリンパ球サブセット Lyt-2陽性Tリンパ球が、有意差をもって、実験群で高値を示した(p<0.05)。Thy1、2及びL3T4陽性Tリンパ球の割合は、各群において差を認めなかった。 Cyclophosphamide投与の糖尿病発症に及ぼす影響 実験群のCP投与群では、9例中4例で糖尿病発症が観察された。生食投与群では6例中糖尿病発症は認められなかった。一方、コントロール群では、12例中7例で糖尿病発症が観察された。 考察 胸腺内細胞注入による抗原呈示の時期は、レシピエントが免疫学的に未成熟な生後1週間以内が望ましいと考えられる。われわれは手技上の問題も考慮し、生後10-11日目のレシピエントを用いた。胸腺内ラ島細胞注入により、糖尿病発症率は有意に抑制されたが、一方コントロール群においても糖尿病発症率は、通常見られるNODマウスの発症率より低かった。手術侵襲によるストレス、あるいは炎症の波及により、糖尿病発症率が低下した可能性が考えられる。胸腺内肝細胞移植群に比し、胸腺内ラ島細胞移植群において膵ラ島炎が有意に抑制されていたことより、糖尿病発症を抑制するためには、ラ島細胞、あるいはその表面抗原が胸腺内に存在し、抗原呈示が適切に行なわれることが必要であると考えられる。 胸腺内アロ抗原注入によるトレランスの導入の機序の一つに、その抗原に対する細胞障害性Tリンパ球の前駆細胞が減少していることが指摘されている。NODマウスを用いた今回の我々の検討では、胸腺内ラ島細胞注入による糖尿病発症の抑制には、サプレッサーT細胞が関与していることが示唆された。 (まとめ) 1.1型糖尿病におけるラ島炎、及びその結果としての糖尿病発症は、新生児期の胸腺内ラ島細胞移植により予防し得る。 2.ラ島炎抑制にはサプレッサーT細胞が関与していることが示唆された。 3.ラ島炎、糖尿病の抑制には、ラ島細胞表面抗原が胸腺内に的確に呈示されることが必要である。 |