薬物の体内動態に関する研究は、薬理作用や安全性を裏付ける上で重要な情報を提供する。特に、安全性に関しては、発現する毒性が薬理作用の延長である場合を除いて、その発現機構について予め予測される例は少なく,薬物の体内動態的特徴を明確にした上でなければ説明が困難である場合が多い。 E6080(図1)は、強力な5-リポキシゲナーゼ阻害作用を有しており、種々の実験喘息モデルにおいて、強い喘息抑制効果が確認されている。一方、安全性に関しては、最小毒性量が、ビーグル犬では、肝(肉茅腫)、ラット、モルモット、アカゲザルでは、腎(尿細管の拡張、尿細管腎炎)に対する影響により決定されている。そこで、筆者は、各種実験動物におけるE6080の体内動態の差異に関して検討を加え、本剤による毒性発現との関連性について知見を得たので以下に述べる。  FIG.1.Chemical structure of 14C-E6080 FIG.1.Chemical structure of 14C-E6080 まず、初めにE6080の代謝経路について検討した。14C-E6080投与後のラット胆汁中の放射能の大部分は、2種の代謝物で説明された。各々の構造は、単離・精製した後、1H-NMRおよびマススペクトルからグルクロン酸抱合体(G)、硫酸抱合体(S)と同定した。14C-E6080投与後の、ラット・モルモット・ビーグル犬・アカゲザルの尿および胆汁中の放射能の大部分はGとSで説明されたので、E6080の主代謝経路はグルクロン酸抱合、硫酸抱合であることが確認された(図2)。次いで、E6080の残留性を検討するために、14C-E6080を24.2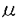 mole/kg経口投与後168時間の臓器中放射能濃度を調べた。ラット、モルモットでは、全ての臓器中放射能濃度は痕跡程度に低下していたが、ビーグル犬、アカゲザルでは、比較的高い放射能が肝および腎に残留した。アカゲザルでは、残留する放射能のほとんどがGで説明されたが、ビーグル犬では、残留する放射能は生体内高分子と強固に結合している代謝物であった。 mole/kg経口投与後168時間の臓器中放射能濃度を調べた。ラット、モルモットでは、全ての臓器中放射能濃度は痕跡程度に低下していたが、ビーグル犬、アカゲザルでは、比較的高い放射能が肝および腎に残留した。アカゲザルでは、残留する放射能のほとんどがGで説明されたが、ビーグル犬では、残留する放射能は生体内高分子と強固に結合している代謝物であった。  FIG.2.Metabolic pathways of E6080 FIG.2.Metabolic pathways of E6080 アセトアミノフェン・buthylated hydroxy toluene等が引き起こす臓器障害、ある種の酸性薬物に関してはその代謝物が引き起こすアレルギー反応は、薬物と生体高分子が共有結合して形成される代謝物(以下、CBと略す)に起因するといわれている。E6080の、ビーグル犬における肝障害もCBの生成に起因していると想定し、その生成機構について14C-E6080と肝Msを用いて検討した。 ラット、アカゲザルでは、NADPHの存在下CB生成は増強されたが、ビーグル犬では、NADPH依存性は認められなかった。還元型グルタチオン、システインの添加、あるいは、N-エチルマレイミド処理によりCBの生成は著しく減少したことから、生体のSH基とE6080が反応してCBを生成することが示唆された。煮沸後のMsに関してもCB生成が認められること、酸化剤の添加によりCB生成が促進されることから、ビーグル犬においては非酵素的な機構で主にCBを生成すると推察された。なお、G、SのCB生成への関与を検討したが、ともに不活性体であった。この意味で、抱合反応は解毒的に働いていることが判明した。そこで、E6080に対する抱合活性の臓器分布とその種差について検討を加えた。E6080に対するグルクロン酸抱合活性および硫酸抱合活性は、種によって活性の分布、強さが異なっており、ビーグル犬の小腸、肝におけるE6080に対する抱合活性は他の動物種と比べて低いことが明らかとなった。以上から、ビーグル犬にのみCBの形成が顕著に認められたことは、ビーグル犬の小腸・肝におけるE6080に対する抱合活性が低いために、経口投与時、肝に対する未変化体の暴露量が他の動物種に比して大きくなるためと推察された。14C-E6080を経口投与した時の血漿中非結合型未変化体のAUCは、ビーグル犬では他種動物と比して高く、このことからもビーグル犬では抱合活性が低いことが裏付けられた。 E6080血球中濃度は、全ての動物種で、血漿中濃度の100〜300倍高く推移していた。そこで、E6080の血球結合蛋白について検討したところ、ラット血球では、高親和性の結合(Kd=-13.7nM)と低親和性の結合(Kd=40.1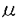 M)が認められ、前者は、炭酸脱水酵素(CA)によることを確認した。また、抱合体の血球への移行性は非常に低かった。生体内のCAは、大部分血球中に存在するが、腎にも存在し、尿pHの調節に重要な役割を果たす。そこで、ラット腎よりCAを精製し、E6080および、抱合体の結合親和性を検討した。E6080の解離定数は、血球の値とほぼ同等の14nMであり、G、Sも高い親和性を有しており、解離定数は各々26、15nMであった。E6080とその抱合体の肝、小腸、筋肉における蛋白結合性を測定したところ、得られた解離定数は、数 M)が認められ、前者は、炭酸脱水酵素(CA)によることを確認した。また、抱合体の血球への移行性は非常に低かった。生体内のCAは、大部分血球中に存在するが、腎にも存在し、尿pHの調節に重要な役割を果たす。そこで、ラット腎よりCAを精製し、E6080および、抱合体の結合親和性を検討した。E6080の解離定数は、血球の値とほぼ同等の14nMであり、G、Sも高い親和性を有しており、解離定数は各々26、15nMであった。E6080とその抱合体の肝、小腸、筋肉における蛋白結合性を測定したところ、得られた解離定数は、数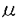 M以上であり、CAとの親和性は、特異的に高いことが明らかになった。腎では、E6080に対する抱合活性が検出されるので、血球と異なり、未変化体の他に腎臓内で産生されたG、Sが共存することが予想され、これら3者が、腎のCAを阻害している可能性が考えられた。そこで、E6080未変化体とともに、抱合体のラットにおける体内動態について検討した。 M以上であり、CAとの親和性は、特異的に高いことが明らかになった。腎では、E6080に対する抱合活性が検出されるので、血球と異なり、未変化体の他に腎臓内で産生されたG、Sが共存することが予想され、これら3者が、腎のCAを阻害している可能性が考えられた。そこで、E6080未変化体とともに、抱合体のラットにおける体内動態について検討した。 ラットに0.48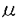 mole/kgを動脈内投与後、2.5分で、投与量の約6割もが血球中に存在する。そこで、非結合型E6080の血球膜に対する拡散定数(CLdr)を求めたところ、CLdr=1055ml/min(/ml RBC)を得た。この結果から、血漿中と血球中の薬物は瞬時に平衡に達するとはいえないことが示唆された。 mole/kgを動脈内投与後、2.5分で、投与量の約6割もが血球中に存在する。そこで、非結合型E6080の血球膜に対する拡散定数(CLdr)を求めたところ、CLdr=1055ml/min(/ml RBC)を得た。この結果から、血漿中と血球中の薬物は瞬時に平衡に達するとはいえないことが示唆された。 臓器中と臓器から流出する血液中の非結合型薬物濃度は、等しいと近似できる場合の、最も簡単なモデルを、図3(A)に示した。また、血球と血漿で瞬時平衡が仮定できない場合には、図3(B)に示したモデルとなる。E6080に関しては、図3(B)に示したモデルを基本に考え、小腸、肝および腎臓中濃度を算出した。また、抱合体の臓器中濃度推移に関しては、図3(A)に示したモデルをもとに算出した。 14E6080を0.48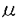 mole/kg動脈内投与後の赤血球中および血漿中E6080、G、Sの濃度推移を用いて、臓器へのインプット関数とし、肝と小腸における未変化体(図4)および抱合体(図5)の濃度推移を予測したところ、実測値とよく一致していた。なお、図4中点線は、CLdr=0と仮定したときの推移であり、肝においては、血球からの薬物移行が無視し得ないことが示された。腎に関しては、腎細胞からのE6080の膜透過に律速過程があると仮定して、実測値から膜透過係数の最適値を得た。腎中抱合体に関しても、膜透過律速を設定した。膜透過律速を設定しなかった場合と比べて、腎中抱合体は、10倍以上高い濃度で推移していた(図5(C))。腎中の未変化体および、抱合体の濃度推移から、投与後8時間においても、腎中CAの30%以上が、未変化体あるいはその抱合体と結合しているという結果を得た。全身の抱合体産生に関しては、肝、小腸と腎で、投与量の約80%を産生するものと推定された。腎は、投与量の約10%をGに変換する。ラット肝Msを用いて、E6080グルクロン酸抱合活性に対する誘導剤の影響について検討したところ、フェノバルビタールは無影響であったが、3-メチルコランスレンと mole/kg動脈内投与後の赤血球中および血漿中E6080、G、Sの濃度推移を用いて、臓器へのインプット関数とし、肝と小腸における未変化体(図4)および抱合体(図5)の濃度推移を予測したところ、実測値とよく一致していた。なお、図4中点線は、CLdr=0と仮定したときの推移であり、肝においては、血球からの薬物移行が無視し得ないことが示された。腎に関しては、腎細胞からのE6080の膜透過に律速過程があると仮定して、実測値から膜透過係数の最適値を得た。腎中抱合体に関しても、膜透過律速を設定した。膜透過律速を設定しなかった場合と比べて、腎中抱合体は、10倍以上高い濃度で推移していた(図5(C))。腎中の未変化体および、抱合体の濃度推移から、投与後8時間においても、腎中CAの30%以上が、未変化体あるいはその抱合体と結合しているという結果を得た。全身の抱合体産生に関しては、肝、小腸と腎で、投与量の約80%を産生するものと推定された。腎は、投与量の約10%をGに変換する。ラット肝Msを用いて、E6080グルクロン酸抱合活性に対する誘導剤の影響について検討したところ、フェノバルビタールは無影響であったが、3-メチルコランスレンと -ナフトフラボンは、活性を著しく上昇させた。このことから、E6080に対するグルクロン酸抱合活性は、生体内に広く分布することが予想された。したがって、今回検討しなかった臓器のグルクロン酸抱合活性が投与量の約20%のG生成に寄与しているものと思われた。全身の抱合体産生に関しては、肝、小腸と腎で、投与量の約80%を産生するものと推定された。腎は、投与量の約10%をGに変換する。ラット肝Msを用いて、E6080グルクロン酸抱合活性に対する誘導剤の影響について検討したところ、フェノバルビタールは無影響であったが、3-メチルコランスレンと -ナフトフラボンは、活性を著しく上昇させた。このことから、E6080に対するグルクロン酸抱合活性は、生体内に広く分布することが予想された。したがって、今回検討しなかった臓器のグルクロン酸抱合活性が投与量の約20%のG生成に寄与しているものと思われた。全身の抱合体産生に関しては、肝、小腸と腎で、投与量の約80%を産生するものと推定された。腎は、投与量の約10%をGに変換する。ラット肝Msを用いて、E6080グルクロン酸抱合活性に対する誘導剤の影響について検討したところ、フェノバルビタールは無影響であったが、3-メチルコランスレンと -ナフトフラボンは、活性を著しく上昇させた。このことから、E6080に対するグルクロン酸抱合活性は、生体内に広く分布することが予想された。したがって、今回検討しなかった臓器のグルクロン酸抱合活性が投与量の約20%のG生成に寄与しているものと思われた。 -ナフトフラボンは、活性を著しく上昇させた。このことから、E6080に対するグルクロン酸抱合活性は、生体内に広く分布することが予想された。したがって、今回検討しなかった臓器のグルクロン酸抱合活性が投与量の約20%のG生成に寄与しているものと思われた。  FIG.3.Venous equilibration model for drug distribution and elimination(A) Assuming the instantaneous equilibration between plasma and RBC In tissue j, mass balance equation is FIG.3.Venous equilibration model for drug distribution and elimination(A) Assuming the instantaneous equilibration between plasma and RBC In tissue j, mass balance equation is  (Eq.1) where, X, Q, Cin, Cout, CLint, and Cf are amount of drug, blood flow rate, concentration of drug in arterial and venous blood, intrinsic clearance and unbound drug concentration. Xj=Vj・ (Eq.1) where, X, Q, Cin, Cout, CLint, and Cf are amount of drug, blood flow rate, concentration of drug in arterial and venous blood, intrinsic clearance and unbound drug concentration. Xj=Vj・ j・Cfj where Vj is the volume of tissue j, and j・Cfj where Vj is the volume of tissue j, and  x is a binding efficacy defined as x is a binding efficacy defined as  (Eq.2) Under the linear condition (i.e.Kdxi>>Cfx), (Eq.2) Under the linear condition (i.e.Kdxi>>Cfx),  x can be treated as a constant, then transformation of Eq.1 results in: x can be treated as a constant, then transformation of Eq.1 results in:  (Eq.3) (B) Assuming diffusion between plasma and RBC operates as a barrier Mass balance equations in tissue j and RBC in tissue j are as follows : (Eq.3) (B) Assuming diffusion between plasma and RBC operates as a barrier Mass balance equations in tissue j and RBC in tissue j are as follows : =Qrj・(Crinj-Crj)+Vrj・CLdr・(Cfj-Cfrj) =Qrj・(Crinj-Crj)+Vrj・CLdr・(Cfj-Cfrj)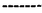 (Eq.4) (Eq.4)  =Qpj・(Cinj-Coutj)+Vrj・CLdr・(Cfrj-Cfj)-CLint,j・Cfj =Qpj・(Cinj-Coutj)+Vrj・CLdr・(Cfrj-Cfj)-CLint,j・Cfj 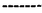 (Eq.5) where subscript r and p represents RBC and plasma, respectively. Under the linear condition, Eqs. 4 and 5 can be transformed as follows : (Eq.5) where subscript r and p represents RBC and plasma, respectively. Under the linear condition, Eqs. 4 and 5 can be transformed as follows :  (Eq.6) (Eq.6)  (Eq.7) (Eq.7) FIG.4.Concentration of E6080 in intestine (A), liver (B) and kidney (C) after intraarterial dosing of 14C-E6080 (0.48 FIG.4.Concentration of E6080 in intestine (A), liver (B) and kidney (C) after intraarterial dosing of 14C-E6080 (0.48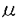 mole/kg) to bile duct cannulated rats Each point represents the mean with S.D.of 3 animals. mole/kg) to bile duct cannulated rats Each point represents the mean with S.D.of 3 animals. FIG.5.Concentration of glucuronide and sulphate in intestine (A),liver (B) and kidney (C) after intraarterial dosing of 14C-E6080 (0.48 FIG.5.Concentration of glucuronide and sulphate in intestine (A),liver (B) and kidney (C) after intraarterial dosing of 14C-E6080 (0.48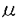 mole/kg) to bile duct cannulated ratsKeys ; △, Glucuronide ; ▲, Sulphate Each point represents the mean with S.D.of 3 animals. mole/kg) to bile duct cannulated ratsKeys ; △, Glucuronide ; ▲, Sulphate Each point represents the mean with S.D.of 3 animals. 以上のことから、E6080投与時に認められた1)肝に対する影響毒性は、未変化体のCB生成と関連しており、その生成は、投与量と肝および小腸の抱合活性の活性に依存すること、2)腎に対する影響は、腎中CAの阻害に基づくと考えられ、その阻害は、未変化体のみならず抱合体も関与していること、さらに、腎からのE6080および抱合体の消失に関して膜透過律速が存在している可能性が高く、これが、腎中CAの阻害時間を延長していることが示唆された。 本研究ではE6080を用いて、in vitroで求めた抱合活性および蛋白結合性をin vivoに適用することの妥当性を確認した。膜透過性に関しては、in vitro系でこれを査定し、in vivoに適用していくために、今後の検討が必要であるが、本研究で示した、代謝物の生成部位、組織蛋白結合の競合などを考慮した体内動態的アプローチは、生体反応を定量的に解明する手段として有用と思われる。 |