学位論文要旨
| No | 211967 | |
| 著者(漢字) | 永根,基雄 | |
| 著者(英字) | ||
| 著者(カナ) | ナガネ,モトオ | |
| 標題(和) | 悪性脳腫瘍におけるO6-methylguanine-DNA methyltransferase(MGMT)の発現とACNU耐性の相関、及びantisense RNA療法によるACNU耐性克服の試み | |
| 標題(洋) | ||
| 報告番号 | 211967 | |
| 報告番号 | 乙11967 | |
| 学位授与日 | 1994.10.26 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第11967号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 神経膠腫(glioma)を中心とする悪性脳腫瘍は近年のめざましい医療進歩にも拘わらず依然治療困難な疾患で,正常脳に浸潤する性格から手術的に完治させることはほぼ不可能で,術後の放射線照射や化学療法を併用した集学的治療法に頼らざるを得ないのが現状である. 現在,悪性神経膠腫に対する化学療法の第一選択剤はニトロソウレア系抗癌剤(CENU)であり,わが国では主として水溶性のACNUが使用されている.CENUは中枢神経系に存在する血液脳関門(blood-brain barrier:BBB)の透過性が高く,BBBが比較的保たれている腫瘍辺縁部のviable cellへの到達性にも優れている.またcell cycle-nonspecificに作用するため,悪性神経膠腫の70%を占めるとされる非増殖相の腫瘍細胞に対しても効果が望める利点がある.更にACNUは放射線感受性の最大となるG2/M期に腫瘍細胞を集積させる作用もあり,放射線増感効果も期待できる.しかし,このような利点を有するACNUを使用しても,CT上腫瘍消失率は僅かに5%,奏効率も半数以下の40%,中間生存値約50週に過ぎず,過半数の症例でACNU無効と考えられる.また,初期治療には良好に反応しても,ACNUによる維持療法中に再発し,ACNU感受性を失う場合も多く認められ,腫瘍細胞・組織におけるACNU耐性機構(自然耐性及び獲得耐性)の存在が重要な問題となってくる. CENUはbifunctionalなアルキル化作用により抗腫瘍効果を発揮する.即ち,先ずCENUのchloroethyl基がDNA分子中のguanine塩基の主としてO6部位に結合してO6-alkylguanineが形成される.このO6-alkylguanineは引き続き相補的なDNA鎖のcytosineと不可逆的なDNA interstrand cross-linkを形成する.その結果,腫瘍細胞はDNA複製ができなくなり最終的に細胞死に至ると考えられる.ところが,細胞にはCENUにより障害を受けたDNAを,正常のDNAに修復してしまう特異なDNA修復酵素,O6-methylguanine-DNA methyltransferase(MGMT)が存在することが明らかとなってきた.MGMTはO6-alkylguanineのO6部位に結合したアルキル基を選択的に除去し,受容基であるcodon 145のcysteine残基に不可逆的に受け取ることでDNAを修復し,且つ自身は失活してしまう自殺酵素である.Tsujimuraらにより各臓器癌由来細胞株のMGMT活性がACNU耐性度と良く相関することが報告され,MGMTがACNU耐性の主因となることが示唆された.従って,MGMT活性値をACNU投与以前に測定することは,化学療法の治療計画を検討する上で有意義な情報となると考えられる.ところが,MGMT活性の測定方法としては,これまで3Hを含むメチル化DNAを使用する煩雑な方法がとられてきた.しかもこの方法では測定に大量の腫瘍組織・細胞が必要とされるため一般化されにくかった.近年,Tanoらによりhuman MGMTのcDNA構造が解明され,mRNAレベルでのMGMT発現量の解析が可能となった.そこで我々は細胞株と組織標本を用い,Northern blot法によりMGMTのmRNA発現量を測定し,それをもとにACNU耐性度を測定できる方法の開発を試みた. まず,human及びmurine glioma細胞株計12種,手術摘出組織標本58例(原発性悪性脳腫瘍34例,転移性脳腫瘍16例,良性脳腫瘍6例,正常脳(大型深在性腫瘍摘出の際,腫瘍への到達のため切除された)2例)でのMGMT mRNAの発現量を検討した.内,細胞株12例と組織から得られた初代培養12例ではcolony形成能試験によりACNU耐性度を測定し,Northern法で得られた結果と比較した. Northern blot分析の結果,human glioma細胞株ではSF-188で0.95kbのサイズにMGMT mRNAの著明な発現が認められ,U-138MGでも強い発現がみられた.他の5種の細胞株ではMGMTの発現は検出されなかった.脳腫瘍組織標本では,約80%の腫瘍でMGMT mRNAの発現が認められた.組織別にみると,low grade astrocytomaやoligodendrogliomaでは発現が低く,malignant gliomaでは中等度に発現がみられる傾向が認められた.また,colon cancer,lacrimal gland carcinoma等からの転移性脳腫瘍や,良性脳腫瘍のneurinoma,meningiomaではMGMTが高発現の症例が多くみられた(Fig.1).個々の組織間では発現量は異なり,個体間のvariationが存在すると考えられた. 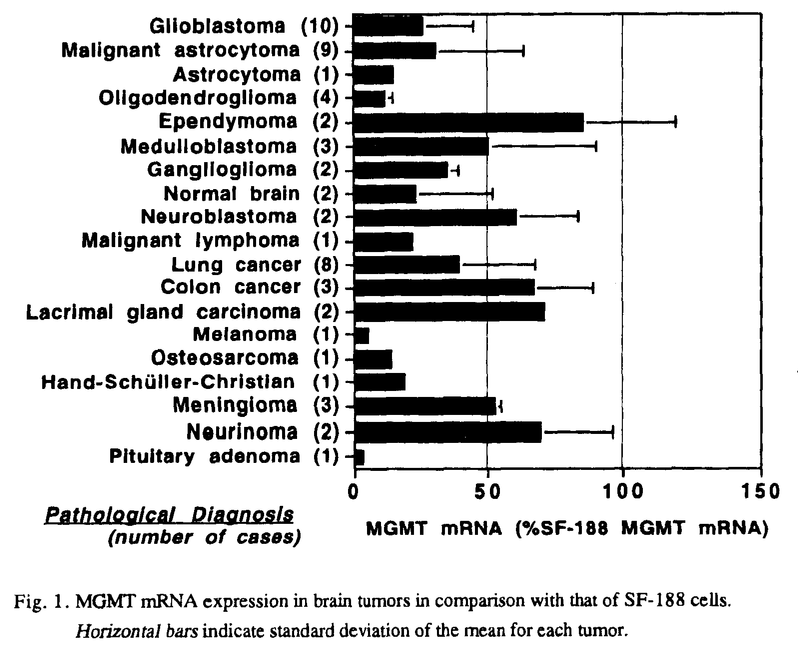 human及びmurine glioma細胞株,悪性脳腫瘍組織の初代培養細胞を用いたcolony形成能試験の結果をもとに,横軸にMGMT mRNA発現量(対SF-188 MGMT mRNA),縦軸に1 log killをもたらすACNU濃度:SD10値をプロットすると,両者の間には正の相関関係が認められ(r=0.825,p<0.0001),MGMT mRNAの発現量は細胞のACNU耐性度を反映した(Fig.2).故に,今回我々が開発したNorthern blot法によるMGMT mRNA発現量の測定法はACNU耐性評価法として有用であると考えられる. 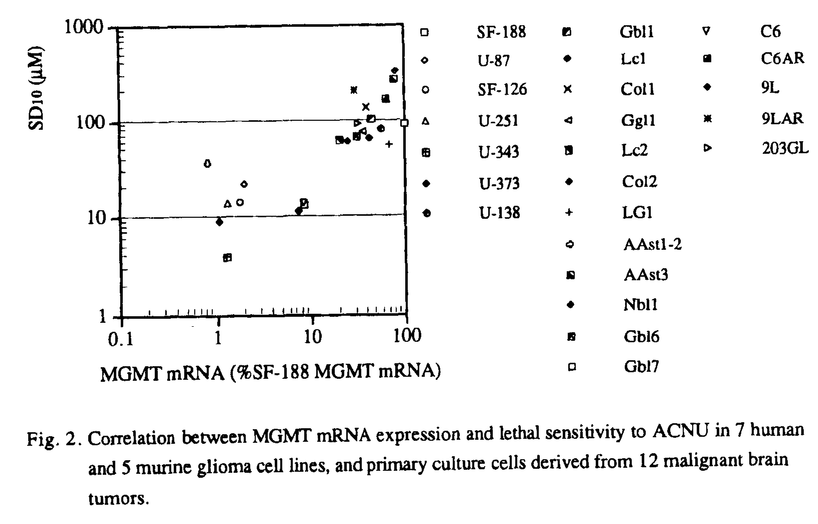 次に,細胞或いは組織間におけるMGMT mRNA発現量の違いが,遺伝子上の変化によるものかを検討するため,MGMT mRNAの発現が(+)及び(-)のhuman glioma細胞株計5種を用いて,Southern blot分析を行った.制限酵素EcoRIで消化後,coding regionの266bpのMGMT cDNAをprobeとした結果,U-138MG株で軽度増幅がみられた他はいずれの細胞株でもほぼ同等の23kbpのbandが検出された.また,MGMT promoter領域の1kbp DNA断片をprobeとして用いたhybridizationでも各細胞間に差は認められなかった.従って,MGMT mRNA発現量は,MGMT遺伝子の欠失や転位など遺伝子レベルの変化によるものではなく,主として転写或いは転写後レベルで制御されている可能性が示唆された. sublethal doseのACNUを持続投与して樹立したrat gliomaのACNU耐性株,C6AR及び9LARでは,MGMT mRNAの発現が親株のC6,9Lと比べ定常的に亢進していた.また他の薬剤耐性関連遺伝子であるglutathione S-transferase- MGMTの発現がみられる場合に,ACNU以外の薬剤を選択して術後化学療法を施行する方法は合理的ではあるが,上記の如き悪性脳腫瘍に対する利点を有しているCENUが投与できないことは治療上大いに不利となる.更に今回の結果では脳腫瘍の80%はMGMTの発現を示すことから,MGMT活性を抑制しACNU耐性を克服することは治療成績の向上を図るためにも極めて重要な課題となってくる. これまで,MGMTのもつ自殺酵素という特殊性に注目し,streptozotocin等DNAにO6-alkylguanineを形成する物質,或いはO6-benzylguanine等MGMTの基質となる物質を前投薬することでMGMTを枯渇させる方法が試みられているが,MGMTが新たに産生されてくるためMGMT活性が一過性にしか低下しない問題があった.そこで我々はACNUでMGMTを枯渇させた後,MGMT蛋白の発現を抑制する方法に注目した.蛋白はmRNAがribosomeで翻訳されて合成されてくる.或るmRNAに特異的な相補的配列を持つantisense RNAが存在すれば,本来のmRNAとの間で水素結合により2本鎖が形成され,そのためmRNA上のribosomeの進行が止められ翻訳反応が阻害される.そこでMGMT mRNAに特異なantisense RNAを用い,MGMT蛋白質合成を阻害することでACNU耐性の克服ができるか否かを検討した. MGMT antisense RNAを細胞内で直接発現させるため,MGMT mRNAの開始コドンを含む前後59bのantisense配列を,外部からZn2+等の金属イオンで発現を誘導できるhuman metallothionein promoterをもつ発現vectorに接続することで,MGMT antisense RNAを発現できるvectorを構築した.この発現vectorを,rat glioma細胞株C6のACNU耐性変異株で,MGMTを高発現しているC6ARに遺伝子導入した.得られたtransfectant cloneに,Zn2+150〜160 これらの結果から,親株(C6AR),antisense RNA発現株(AS4,AS28),及びcontrolとして開始codon部のsense RNA発現株(S2,S6)を用いて以下のcolony形成能試験を計画した.Zn2+は,高濃度では細胞傷害性があるため,細胞が安定して増殖しうる濃度(100 その結果,Zn2+で発現を誘導しないACNU治療単独では,C6AR,AS4,AS28及びS2,S6ともにACNUの耐性はほぼ同程度であり,transfectionによる影響は無視できると考えられた.また,10 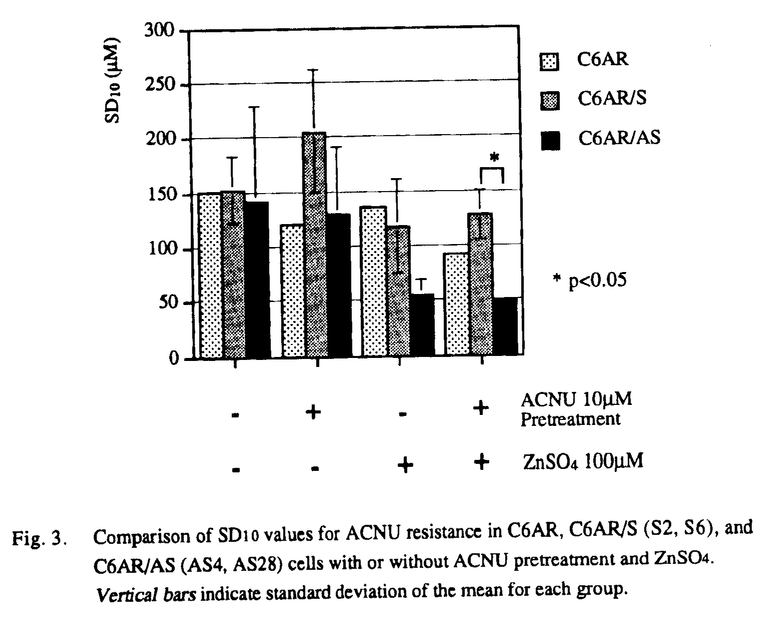 今回構築したMGMT antisense RNA発現vectorにより,ACNU耐性rat glioma細胞株でACNU感受性が2.5倍に増強されたことから,MGMT antisense RNAによるACNU耐性克服の有効性がin vitroで示唆された.今後更に,MGMTに対する特異的抗体を作製することで,蛋白合成レベルで検討を加えていく予定である. | |
| 審査要旨 | 本研究は,悪性脳腫瘍の化学療法における中心的薬剤であるニトロソウレア系抗癌剤(ACNU)に対する薬剤耐性機構として,アルキル化されたDNAの特異的修復酵素であるO6-methylguanine-DNA methyltransferase(MGMT)の関与を明らかにするため,MGMT mRNAの発現とACNU耐性の相関性を解析し,ACNU耐性測定法の開発を試みたものである.更に,得られた結果をもとに,MGMTに対する特異的antisense RNAを発現誘導する系にて,ACNU耐性rat glioma細胞(C6AR)に対するACNU耐性克服の試みを検討し,下記の結果を得ている. 1.human及びmurine glioma細胞株計12種,手術摘出組織標本58例(原発性悪性脳腫瘍34例,転移性脳腫瘍16例,良性脳腫瘍6例,正常脳(大型深在性腫瘍摘出の際,腫瘍への到達のため切除された)2例)でのMGMT mRNA発現量の解析の結果,human glioma細胞株7種ではSF-188及びU-138MGの2種で0.95kbのMGMT mRNAの著明な発現が認められたが,他の5種では明らかなMGMTの発現は検出されなかった.脳腫瘍組織標本では,約80%の腫瘍でMGMTの発現が認められ,細胞株に比べMGMT発現率が高い傾向を示した.組織別では,low grade astrocytoma,oligodendrogliomaでMGMT mRNAの発現は低く,malignant gliomaで中等度の発現傾向がみられた.また,転移性脳腫瘍(colon,lung cancer等)や良性脳腫瘍(neurinoma,meningioma)の多くでMGMT mRNAの高発現が認められた. 2.各種glioma細胞株及び初代培養細胞を用いてACNUに対するcolony形成能試験を施行した結果,SD10値(1 log killをもたらすACNU濃度)が50 3.human glioma細胞株5種にてMGMT遺伝子のSouthern blot解析を行ったところ,いずれの細胞株でもほぼ同等のシグナルが検出された.解析した領域内でのMGMT遺伝子の欠失・転位及び顕著な遺伝子増幅は認められず,MGMT mRNA発現は主として転写或いは転写後に制御されている可能性が示唆された. 4.ACNU感受性を示すrat glioma細胞株C6,9Lに対し,sublethal doseのACNUを持続投与して樹立した各ACNU耐性株C6AR,9LARでは,MGMT mRNAの発現が親株と比較し定常的に亢進しており,ACNU耐性の獲得にMGMTの発現が関与していることが示唆された, 5.MGMT mRNAの高発現を伴うACNU耐性に対し,MGMT発現をアンチセンスで抑制するMGMT antisense RNA療法によるACNU耐性克服を検討するため,Zn2+イオンにより発現を誘導できるhuman metallothionein promoterをもつ,MGMTの翻訳開始コドンの前後59bを含むMGMT antisense RNA発現vectorを新たに構築した.このvectorをACNU耐性を示すC6AR細胞に遺伝子導入し,MGMT antisense RNAを発現しうるsubclone(AS3,AS4,AS28)を選別した.これらの細胞をZnSO4で処理したところ,Zn2+濃度依存性にMGMT antisense RNAの発現が誘導された.またこの発現誘導は投与3時間後には認められ,12時間後に最大となり以降徐々に減少することが示された. 6.上記5の結果をもとに,ZnSO4によるMGMT antisense RNAの発現誘導を24時間毎に行い,ACNUに対するcolony形成能試験を施行したところ,逆に同じ59bのsense MGMT RNAを発現するvectorをtransfectしたclone(S2,S6)に比べ,MGMT antisense RNA発現clone(AS4,AS28)ではACNUに対するSD10値が約50%に減少した.更に,既に細胞内に存在するMGMTを消費する目的でACNU 10 以上,本論文は,gliomaを中心とする悪性脳腫瘍において,主たる化学療法剤であるACNUに対する耐性が,MGMT mRNAの発現量に相関することを明らかにした.また,ACNU耐性の主因となるMGMTの発現を,MGMT antisense RNAの導入により抑制することで,ACNU耐性克服の可能性を明らかにした.本研究は,これまで化学療法を含めた集学的治療にも関わらず,極めて予後不良である悪性脳腫瘍の治療において,薬剤耐性機構の解明及び有効な化学療法の開発に重要な貢献をなすと考えられ,学位の授与に値するものと考えられる. | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50907 |
 mRNAの発現はいずれの株でも検出されず,metallothionein mRNAの発現も各親株とほぼ同様軽度であり,ACNU耐性の獲得にMGMTの発現が関与していることが示唆された.
mRNAの発現はいずれの株でも検出されず,metallothionein mRNAの発現も各親株とほぼ同様軽度であり,ACNU耐性の獲得にMGMTの発現が関与していることが示唆された. Mを投与し6時間後に抽出したmRNAでNorthern blotを行った所,約0.4kbのMGMT antisense RNAの発現が誘導されたclone(AS3,AS4,AS28等)が得られた.このZn2+による発現誘導は,dose dependent且つtime dependentに変化した.即ち,Zn2+100
Mを投与し6時間後に抽出したmRNAでNorthern blotを行った所,約0.4kbのMGMT antisense RNAの発現が誘導されたclone(AS3,AS4,AS28等)が得られた.このZn2+による発現誘導は,dose dependent且つtime dependentに変化した.即ち,Zn2+100