蛋白質は、生命活動の維持において重要な役割を持っており、その触媒としての優れた性質は、古くから知られていたものの、高分子量で複雑な構造ゆえに、最近になるまで、一つのブラックボックスとして取り扱う以外に方法がなかった。しかし、X線結晶解析やNMRの手法が発達し、蛋白質という高分子の立体構造を解析することが可能となった。また、遺伝子操作技術もめざましく進歩し、蛋白質をコードする遺伝子を取得し、部位特異的に変異を導入することにより、自然界には存在しない蛋白質を作り、その機能を制御及び解析すること、すなわち蛋白質工学も普遍的な技術となった。そこで、それらの技術を総合的に用い、キモシン及びシュードアズリンの構造と機能の相関を解析することを目的として、以下の研究を行った。 1.キモシン キモシンは、生後間もない子牛の第4胃に存在する酵素で、古くからチーズ製造に利用されてきた。キモシンはチモーゲン(プロキモシン)として分泌され、胃の中の酸性条件下で自己触媒的にプロ部分を限定分解して成熟型キモシンとなる。この酵素の特徴は、カッパーカゼインを限定分解して凝乳を引き起こすが、非特異的なプロテアーゼ活性が弱く、凝乳活性/プロテアーゼ活性比(C/P値)が大きいこと、及び、凝乳後の加熱処理で速やかに分解して、必要以上の蛋白質の分解を起こさないことである。それらの特徴は、風味の良いチーズを作るための重要な要素である。 そこで、まず、それらの特徴を決定する部位を探るため、ランダムなリンカー挿入を試みた。様々な変異酵素を、活性のあるものとないものに分類すると、活性のあるものは分子表面近くへの、活性のないものは、分子の内部とくに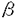 シートへの挿入であった。特に興味深かった変異体は、107P-108G間へ挿入したもので、C/P値が大きく上昇していた。 シートへの挿入であった。特に興味深かった変異体は、107P-108G間へ挿入したもので、C/P値が大きく上昇していた。 続いて、種々のアスパラギン酸プロテアーゼの一次構造及び三次構造を比較し、特徴ある部位について改変体を作製した。一次構造上保存性が高く、立体構造上アスパラギン酸プロテアーゼに特徴的なフラップ領域上に存在するTyr75に注目し、Pheに置換したところ、凝乳活性に比べてプロテアーゼ活性が大きく減少し、C/P値は未改変のものの1.9倍となった。さらに、2種類の合成ペプチドを基質として速度論的解析を行った。未改変のものに比べて、ペプチドI(Leu-Ser-Nph-Nle-Ala-Leu-OMe)では、顕著にkcatが低下をしたのに対し、ペプチドII(Lys-Pro-Ile-Glu-Phe-Nph-Arg-Leu-OH)では、主にKmが上昇した。このことは、S1サブサイトを形成するアミノ酸の置換によって、単に酵素基質複合体の解離定数(Km)が変化するのみではなく、複合状態そのものが変化し、基質の種類に依存して、速度定数(kcat)と解離定数が総合的に変化することを示している。また、同じS1サブサイトに属し、やはり保存性の高いVal110あるいはTyr111も改変した。その結果、これらの部位のアミノ酸残基の変化によっても、やはり基質特異性の変化が観察された。 次に、アスパラギン酸プロテアーゼの活性中心付近のアミノ酸配列は最も相同性の高い部分の一つであるが、その中で、キモシンのみ特異的にLysとなっている220番目のアミノ酸に注目した。このLys220が最適pHの決定に関与しているのではないかと考え、ペプシンと同じLeuに改変した。酸変性ヘモグロビンを基質として、Lys220Leuの活性のpH依存性を検討したところ、最適pHの明らかな低下が認められた。しかし合成ペプチドを基質とした場合、kcatのpH依存性は見い出せず、Kmの変化も未改変のものと同等であった。ところが、Lys220Leuは、プロテアーゼ活性が顕著に上昇しており、合成ペプチドに対するkcatも、未改変の約3倍の値を示した。それとは逆に凝乳活性は低下し、基質特異性がペプシン型への変化を示した。 また、最適pHに関する別なアプローチとして、アスパラギン酸プロテアーゼのなかでは特に高い、中性付近に最適pHを持つレニンに注目した。他のアスパラギン酸プロテアーゼと比較したところ、Thr218及びAsp304がそれぞれSer及びAlaとなっており、この部位は、結晶解析の結果からも、活性中心のイオン化に影響を与え得ることが予想された。そこでキモシンのこれらのアミノ酸をレニン型に変換した。その結果、酸変性ヘモグロビンに対するこれらの改変体の最適pHは、予想に反して低下しており、これらのアミノ酸は、レニンの高い最適pHを決定する要因ではないことが明らかになった。一方、基質特異性を調べたところ、Thr218SerのC/P値は未改変の3.5倍と、著しく増大し、凝乳酵素として優れた性質を示した。このことは、実用上有用な酵素の育種の可能性を示したといえる。 以上の実験は、すべて、大腸菌内で大量に発現して封入体を形成したプロキモシンを8M尿素で可溶化し、pH11程度のアルカリ性にした後、透析によって再構成した後、酸処埋でキモシンに変換して行った。再構成を効率よく行うことは、実用上も重要なことである。プロキモシンのアミノ末端にtrpリーダーペプチドを融合させると、再構成効率が非常に低下する。そこで、再構成に関する知見を得るために、この融合蛋白(CR601)の部位特異的変異を試みたところ、アミノ末端から2番目のLysをAspまたはGluに変換したときのみ再構成効率が改善し、この部位の荷電が再構成に重要な役割を果たしていることが明らかとなるとともに、ただ一つのアミノ酸の変換で再構成効率を大きく上昇させることに成功した。また、透析の方法を、ステップワイズにゆっくりと行うことで、直接発現させたプロキモシン(CR712)も、CR601も、再構成効率が大幅に上昇し、一般的な再構成法としての有効性も示すことができた。 2.シュードアズリン シュードアズリンは、脱窒菌Alcaligenes faecalis S-6株の持つ亜硝酸還元酵素(NIR)に電子伝達する分子量14Kで、タイプI銅原子を1個配位している青色銅蛋白質(キュブレドキシン)である。シュードアズリンの遺伝子はすでにクローニングされており、まずその大量発現系を構築した。その結果、シュードアズリンの生産量は、培地中の銅イオン濃度に依存することがわかった。このことより、シュードアズリンは、銅が配位しない状況では、きわめて不安定であることが示唆された。キュプレドキシンの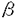 -バレル構造の底部にあたる部分で、保存性の高いTyr74をPheに変えた改変体は、安定な発現のためにより高濃度の銅イオンを必要としており、構造の安定性が低下していることが示唆された。 -バレル構造の底部にあたる部分で、保存性の高いTyr74をPheに変えた改変体は、安定な発現のためにより高濃度の銅イオンを必要としており、構造の安定性が低下していることが示唆された。 続いて、リガンドのCysの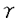 SからCu2+への電荷移動によっておこる青色の吸収極大波長がシュードアズリンは593nmなのに対し、類似の蛋白質であるアズリンは625nmであることに注目した。アズリンとシュードアズリンの立体構造を比べてみると、アズリンでは、この SからCu2+への電荷移動によっておこる青色の吸収極大波長がシュードアズリンは593nmなのに対し、類似の蛋白質であるアズリンは625nmであることに注目した。アズリンとシュードアズリンの立体構造を比べてみると、アズリンでは、この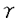 Sは、近くにある主鎖のNHと2つのNH-S間の結合を形成しているが、シュードアズリンでは一方がProとなっているので、NH-S結合が1つしかできない。そのために、励起のために大きなエネルギーが必要となり、吸収極大波長が短いのではないかと考えられた。そこで、Pro80Alaの改変体を作製し、その性質の変化を調べることとした。予想に反して、Pro80Alaの吸収極大波長は変化せず、ESRのスペクトルも未改変のものと同等であった。すなわち、この改変体の銅の配位状態そのものは変化していなかった。しかし、酸化還元電位は、未改変の270mVに対して409mVに大きく上昇し、NIRの不活化活性も未改変のものに対して大きく低下していた。さらに、NIRを「シュードアズリン酸化酵素」と考え、未改変及びPro80Alaシュードアズリンを基質としたそれぞれの場合の速度論的解析を行ったところ、Kmはほとんど変化しなかったが、kcatは各々0.915s-1、0.072s-1となり、改変体では大きく減少していて、電子伝達能そのものが著しく低下していることが明らかになった。そこで、この改変体を大量に精製して、結晶解析を行った。その結果、変異体では、Pro80のシグナルが消滅すると同時に、近傍に水分子によるシグナルが生じることがわかった。この水分子が、銅の配位環境は変えずに、酸化還元電位を上昇させたと考えられる。一般に銅蛋白質内のタイプI銅は、通常の銅イオンの酸化還元電位の170mVより高い酸化還元電位を持つ。今回の改変では、それをさらに上昇させたこととなり、新たな問題を提起することとなった。 Sは、近くにある主鎖のNHと2つのNH-S間の結合を形成しているが、シュードアズリンでは一方がProとなっているので、NH-S結合が1つしかできない。そのために、励起のために大きなエネルギーが必要となり、吸収極大波長が短いのではないかと考えられた。そこで、Pro80Alaの改変体を作製し、その性質の変化を調べることとした。予想に反して、Pro80Alaの吸収極大波長は変化せず、ESRのスペクトルも未改変のものと同等であった。すなわち、この改変体の銅の配位状態そのものは変化していなかった。しかし、酸化還元電位は、未改変の270mVに対して409mVに大きく上昇し、NIRの不活化活性も未改変のものに対して大きく低下していた。さらに、NIRを「シュードアズリン酸化酵素」と考え、未改変及びPro80Alaシュードアズリンを基質としたそれぞれの場合の速度論的解析を行ったところ、Kmはほとんど変化しなかったが、kcatは各々0.915s-1、0.072s-1となり、改変体では大きく減少していて、電子伝達能そのものが著しく低下していることが明らかになった。そこで、この改変体を大量に精製して、結晶解析を行った。その結果、変異体では、Pro80のシグナルが消滅すると同時に、近傍に水分子によるシグナルが生じることがわかった。この水分子が、銅の配位環境は変えずに、酸化還元電位を上昇させたと考えられる。一般に銅蛋白質内のタイプI銅は、通常の銅イオンの酸化還元電位の170mVより高い酸化還元電位を持つ。今回の改変では、それをさらに上昇させたこととなり、新たな問題を提起することとなった。 以上、世界に先駆けて、凝乳酵素プロキモシンにおいては、酵素の基質認識と触媒反応の早さを変化させるために重要なアミノ酸を明らかにし、実用上有用な酵素を得ることができた。また、1アミノ酸の変異によって再構成効率を向上させることに成功した。シュードアズリンについては、酸化還元電位の著明な上昇をもたらすアミノ酸を明らかにするとともに、立体構造の変化について解析した。 |