近年、ハイブリドーマ法で容易に取得できるマウスモノクローナル抗体(MAb)を主体とした治療用MAbの臨床応用が進みつつある。しかしながら、これらの非ヒト由来MAbはヒトに対する抗原性があるため、臨床応用に制限がある。打開策として、現在、マウスMAbを改良しヒトに対する抗原性を低減したヒトーマウスキメラ抗体あるいはヒト型化抗体の作製が進められている。これらの抗体のうちヒト型化抗体は、マウスMAbを構成するアミノ酸のうち抗原結合活性に関与するもの(主としてCDR)を残し、他の領域を可能な限りヒト抗体に置き換えたものであり、全体の約90%がヒト抗体に置き換えられている。しかしながら、ヒト型化抗体作製のストラテジーは必ずしも一定でなく、試行錯誤が繰り返されているのが現状である。これは、ひとつには抗原結合領域の立体構造形成に関する情報が不十分なことによる。本研究では、ヒトIL-2リセプター 鎖に結合し、IL-2/IL-2リセプター結合を阻害することにより免疫抑制作用を有するマウスMAb B-B10を材料に、コンピューターによる立体構造予測に基づいたヒト型化抗体のデザイン、及びその結果を援用した蛋白工学的改変によりヒト型化抗体の作製を行い、その有用性を検討した。 鎖に結合し、IL-2/IL-2リセプター結合を阻害することにより免疫抑制作用を有するマウスMAb B-B10を材料に、コンピューターによる立体構造予測に基づいたヒト型化抗体のデザイン、及びその結果を援用した蛋白工学的改変によりヒト型化抗体の作製を行い、その有用性を検討した。 ヒト型化に際し、マウスB-B10のV領域の立体構造に関する情報が重要であるので、まず立体構造のモデリングを行った。抗体V領域はそのポリペプチド主鎖が逆平行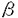 シート構造を基本とするほぼ一定の構造をとる。そして、Chothiaらが提唱するカノニカル構造モデルによれば、主たる抗原結合部位であるCDRのとり得る立体構造は、そのアミノ酸配列及び長さにより分類されるいくつかのグループ内である程度保存されるので、立体構造が未知のCDRを含む抗体V領域でも、立体構造の既知の抗体V領域、CDRをもとにしたコンピューターモデリングによりその立体構造の予測が可能である。この原理に基づいてマウスB-B10V領域にホモロジーが高くかつ立体構造が既知の抗体V領域を選択して鋳型として用い、コンピューターソフトQUANTA/CHARMmにより、マウスB-B10V領域の立体構造を構築した。この立体モデルでは、CDRに属さないk鎖Lys49がCDRにより形成された抗原結合部位に露出しており、抗原結合への関与が推測されたので、ヒト型化に際してこのようなアミノ酸の保存も考慮すべきと考えられた。 シート構造を基本とするほぼ一定の構造をとる。そして、Chothiaらが提唱するカノニカル構造モデルによれば、主たる抗原結合部位であるCDRのとり得る立体構造は、そのアミノ酸配列及び長さにより分類されるいくつかのグループ内である程度保存されるので、立体構造が未知のCDRを含む抗体V領域でも、立体構造の既知の抗体V領域、CDRをもとにしたコンピューターモデリングによりその立体構造の予測が可能である。この原理に基づいてマウスB-B10V領域にホモロジーが高くかつ立体構造が既知の抗体V領域を選択して鋳型として用い、コンピューターソフトQUANTA/CHARMmにより、マウスB-B10V領域の立体構造を構築した。この立体モデルでは、CDRに属さないk鎖Lys49がCDRにより形成された抗原結合部位に露出しており、抗原結合への関与が推測されたので、ヒト型化に際してこのようなアミノ酸の保存も考慮すべきと考えられた。 一方構築されるヒト型化B-B10遺伝子の発現には、緑膿菌外毒素Aに対するヒトモノクローナルIgM抗体FK-001ゲノム遺伝子およびB細胞株であるマウス骨髄腫細胞の利用を考えた。FK-001k鎖遺伝子には特徴的なJk2-Jk5を含む1.8kbの欠失が見られ(図1)、それに伴い組換えシグナルが不活化されていた。これによりCk遺伝子を含むより広範な欠失が抑制され、安定化していると考察されたので、この遺伝子のヒト型化B-B10の安定な発現への利用は妥当と考えられた。FK-001抗体遺伝子を導入されたマウス骨髄腫細胞細胞より分泌される組換えFK-001抗体は、抗原結合活性およびIgM抗体特有の5量体構造においてもとの抗体と同等であり、マウス骨髄腫細胞において抗体分子のprocessing、holding、assemblyが正確に起こっていることが示唆され、この系が組換え抗体の発現に適当であることを意味するものである。  図1.FK-001k鎖遺伝子上の1.8kbの欠失.B:BamHI,H:HindIII,S:SacI. 図1.FK-001k鎖遺伝子上の1.8kbの欠失.B:BamHI,H:HindIII,S:SacI. 以上の点を踏まえ、マウスB-B10のヒト型化に着手した。ヒト型化抗体V領域は基本的にはマウス抗体CDRとヒト抗体フレームワーク(FR)を組み合わせて構築されるが、Chothiaらが指摘するように、一部のFRアミノ酸がCDRの立体構造に影響を及ぼすため、これらについてもマウス抗体由来とする必要がある。これらのアミノ酸が保存される確率を高めるため、組み合わせるヒト抗体V領域は、B-B10V領域のアミノ酸配列とホモロジーが高いものを選択した。さらにこの選択によっても保存されないVHの27-30番目及び94番目のFRアミノ酸はマウスB-B10のアミノ酸とし、ヒト型化B-B10M0をデザインした。さらに抗原結合に関与することが予測された先述のk鎖Lys49またCDR近傍に位置することなどによりCDRの立体構造に影響を与える可能性のあるFRアミノ酸についてもマウスB-B10型に変換し、最終的に9種のヒト型化B-B10V領域をデザインした(図2)。  図2.各種ヒト型化B-B10のアミノ酸配列. 図2.各種ヒト型化B-B10のアミノ酸配列. これらのV領域DNAを合成し、FK-001遺伝子の発現制御領域及びC領域DNAと結合させ、完全なヒト型化B-B10抗体遺伝子(IgG1型)を構築し、マウス骨髄腫細胞にて発現させた。培養上清よりヒト型化B-B10を精製し、その活性化T細胞増殖抑制効果を検討した。その結果、ヒト型化B-B10M0の活性はマウスB-B10の1/10であったのに対し、M0のk鎖Tyr49をマウスB-B10と同じLysに変換したM5では、マウスB-B10と同等のT細胞増殖抑制活性が認められた(図3)。他のヒト型化B-B10の活性はM0と同等かそれ以下であった。以上のことはヒト型化B-B10M5がマウスB-B10とほぼ同等の抗原結合活性を有することを意味し、抗原結合におけるk鎖Lys49の重要性を示すものである。B-B10k鎖49位のアミノ酸の抗原結合における重要性を確認するため、ヒト型化B-B10M0およびM5のV領域の立体構造をモデリングし、マウスB-B10と比較したところ、マウス、M5ではLysがVk CDR2のGluと相互作用しており、Vk CDR2の立体構造形成に大きく作用していること、M0ではこの相互作用がないことを見いだし、抗原結合活性と立体構造の相関性を確認した。k鎮49位のアミノ酸はほとんどの抗体でTyrであり、これらの抗体ではこのアミノ酸のVk CDR2への影響は少ないと考えられる。言い換えれば、k鎖CDR2の立体構造はk鎖49位のアミノ酸によって影響を受けるが、その程度は抗体により異なることを意味するものである。以上の検討の結果、抗体のヒト型化にはコンピューターによる立体構造予測が有効であり、その結果有用性の高いヒト型化抗体が効率よく得られることが明らかになった。  図3.B-B10の活性化T細胞増殖抑制活性の濃度依存性.PHA活性化ヒトT細胞をB-B10存在下IL-2添加培地にて培養し、3日後の細胞数をMTT染色によるOD値で示した。 ●:ヒト型化B-B10M5 ■:ヒト型化B-B10M0 ▲:マウスB-Bl0 図3.B-B10の活性化T細胞増殖抑制活性の濃度依存性.PHA活性化ヒトT細胞をB-B10存在下IL-2添加培地にて培養し、3日後の細胞数をMTT染色によるOD値で示した。 ●:ヒト型化B-B10M5 ■:ヒト型化B-B10M0 ▲:マウスB-Bl0 また、ヒトIgGはサブクラスによりeffector機能が異なるため、臨床応用に際し、サブクラスの選択は重要である。そこでヒト型化B-B10M5IgG1、G2、G3各サブクラスを構築し、移植片対宿主反応(GVHD)のモデル系である混合リンパ球反応に対する抑制活性の比較を行った。検討した中ではヒトIgG1型が抑制効果が最も高く、マウスB〜B10に比較しても数十倍高活性であった(図4)。これは本来のIL-2活性阻害に加え、ヒトIgG1型に変換されたことにより抗体依存性細胞障害活性(ADCC)が増幅されたことによる。このように、ヒト型化抗体はマウス抗体に比較し、生物活性が大きく向上することによりin vivoでの免疫抑制作用も増強が期待できるなどメリットが大きい。マウスB-B10は欧州にてGVHD抑制、移植臓器拒絶反応抑制等の臨床効果が報告されているが、ヒト型化B-B10は、マウスB-B10以上の臨床効果を有すると思われ、その臨床応用が期待される。  図4.ヒト型化B-B10M5各サブクラスの混合リンパ球反応抑制活性.responderのPBMC(105cells/ml)とマイトマイシンC処理したsimulatorのPBMC(105cells/ml)を混合して6日間incubateし、3H-Thymidineの取込みにより評価した。抗体は4日目(day4)に投与した。 図4.ヒト型化B-B10M5各サブクラスの混合リンパ球反応抑制活性.responderのPBMC(105cells/ml)とマイトマイシンC処理したsimulatorのPBMC(105cells/ml)を混合して6日間incubateし、3H-Thymidineの取込みにより評価した。抗体は4日目(day4)に投与した。 |