| 【研究目的】 うっ血性心不全での 遮断薬の使用の有用性を認めた報告が1975年にはじめて報告されて以来、それを支持するデータや、否定的なデータが示されてきた。現段階では、症例の選択や薬剤の種類や投与量などいくつかの問題は残されているが、 遮断薬の使用の有用性を認めた報告が1975年にはじめて報告されて以来、それを支持するデータや、否定的なデータが示されてきた。現段階では、症例の選択や薬剤の種類や投与量などいくつかの問題は残されているが、 遮断薬が有効な症例が存在することは事実と考えられる。 遮断薬が有効な症例が存在することは事実と考えられる。 従来禁忌と考えられていた 遮断薬が奏功する理由として、カテコラミンの直接の心筋毒性を防御する、心筋酸素需要量を軽減させる、不整脈の発生を抑えるなど、いくつかの機序があげられているが、減少した心筋 遮断薬が奏功する理由として、カテコラミンの直接の心筋毒性を防御する、心筋酸素需要量を軽減させる、不整脈の発生を抑えるなど、いくつかの機序があげられているが、減少した心筋 受容体数を回復することも原因の一つにあげられている。 受容体数を回復することも原因の一つにあげられている。 ところで、刺激薬の 受容体は高親和性と低親和性の2種類に区別され、カテコラミンの刺激を促進性結合蛋白質を介してアデニル酸シクラーゼを活性化させ 受容体は高親和性と低親和性の2種類に区別され、カテコラミンの刺激を促進性結合蛋白質を介してアデニル酸シクラーゼを活性化させ 作用を発現させる生理的な機能を有する受容体は高親和性受容体であるが、従来の検討では親和性の区別をしているものが少なかった。実際、圧負荷肥大心の動物モデルでは総受容体数は不変又は増加の傾向にあったものが、高親和性部位は減少していたことを認めた報告もある。 作用を発現させる生理的な機能を有する受容体は高親和性受容体であるが、従来の検討では親和性の区別をしているものが少なかった。実際、圧負荷肥大心の動物モデルでは総受容体数は不変又は増加の傾向にあったものが、高親和性部位は減少していたことを認めた報告もある。 また、最近心不全の治療に強心薬を使用したところ、長期予後に関して否定的な結果を報告しているものが多い。このような薬剤の使用は 受容体の減少傾向を増悪させるのであろうか?このような観点から、本研究では心筋症ハムスターを用いて、 受容体の減少傾向を増悪させるのであろうか?このような観点から、本研究では心筋症ハムスターを用いて、 遮断薬および 遮断薬および 刺激薬を投与して心筋の 刺激薬を投与して心筋の 受容体、アデニル酸シクラーゼ系に与える影響を検討した。さらに、圧負荷肥大心のモデルをラットで作製して、慢性的な血圧の上昇が 受容体、アデニル酸シクラーゼ系に与える影響を検討した。さらに、圧負荷肥大心のモデルをラットで作製して、慢性的な血圧の上昇が 受容体系に与える影響もあわせて検討した。 受容体系に与える影響もあわせて検討した。 【方法】 心筋症ハムスターBIO14.6と健常ハムスターF1Bにメトプロロール(1mg/kg/day)(BIO:n=10,F1B:n=5)またはデノパミン(1mg/kg/day)(BIO:n=9,F1B:n=5)を投与した群と薬剤を投与しなかった群(BIO:n=10,F1B:n=4)で心筋の 受容体について検討した。ハムスターは8週齢のものを用い、薬剤は12週間にわたり経口的に投与した。 受容体について検討した。ハムスターは8週齢のものを用い、薬剤は12週間にわたり経口的に投与した。 受容体の測定は[125I]iodocyanopindolol(ICYP)とisoproterenolの結合実験より置換曲線を求めコンピュータで最少二乗法のプログラムより受容体数、解離定数を算出した。アデニル酸シクラーゼ活性はアデニル酸シクラーゼがATPに作用してcAMPを生成する反応より[3H]ATPから生ずる[3H]cAMPを測定し、受容体をイソプロテレノールで、促進性G結合蛋白質をGTP同族体5’-guanylylimidodiphosphate(Gpp(NH)p)で、アデニル酸シクラーゼ触媒蛋白質をフォルスコリン誘導体(NKH477)で各々刺激した状態についても検討した。 受容体の測定は[125I]iodocyanopindolol(ICYP)とisoproterenolの結合実験より置換曲線を求めコンピュータで最少二乗法のプログラムより受容体数、解離定数を算出した。アデニル酸シクラーゼ活性はアデニル酸シクラーゼがATPに作用してcAMPを生成する反応より[3H]ATPから生ずる[3H]cAMPを測定し、受容体をイソプロテレノールで、促進性G結合蛋白質をGTP同族体5’-guanylylimidodiphosphate(Gpp(NH)p)で、アデニル酸シクラーゼ触媒蛋白質をフォルスコリン誘導体(NKH477)で各々刺激した状態についても検討した。 圧負荷肥大心モデルのラットの作製には片腎を摘出し、deoxycortico-sterone pivalate(DOC)1.5mg/100mgを週2回皮下注し飲料水に生理食塩水を用いて12週間飼育して作製した。片腎摘出の手術を施行したが皮下注射や生理食塩水の飲料水を用いなかった群を対照群とした。以下 受容体、アデニル酸シクラーゼ活性の測定はハムスターと同様に行った。 受容体、アデニル酸シクラーゼ活性の測定はハムスターと同様に行った。 【結果】 ハムスター群:体重で補正した心重量はF1Bと比較してBIOで増加していたが、メトプロロール投与群では増加の程度が無投薬の群と比較して有意に軽度であった。一方デノパミン群は無投薬の群と同程度の補正心重量の増加を認めた(図1)。 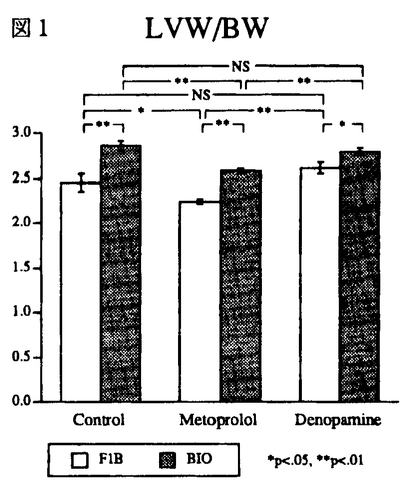 図1 図1 心筋の 受容体は図2に示すようにGpp(NH)pを加えてICYPとイソプロテレノールの結合実験を行ったところ置換曲線は右方へ変位し結合部位が単一でないことが示された(図2)。 受容体は図2に示すようにGpp(NH)pを加えてICYPとイソプロテレノールの結合実験を行ったところ置換曲線は右方へ変位し結合部位が単一でないことが示された(図2)。 受容体数(表1)は無投薬群のBIOで減少していたが高親和性受容体の減少が主であった。メトプロロール投与によりこの減少の回復が認められたが、健常ハムスターにも同様の変化が認められた。デノパミンの投与の影響はBIOで総数では統計上有意差は認められなかったが、高親和性部は有意に増加していた。解離定数はメトプロロール投与群のBIOの高親和性部で増大しており親和性の低下が認められた(F1B7.5nM±1.2vs BIO17.1±3.1,p<.05)。そのほかの解離定数に関しては有意差は認められなかった。 受容体数(表1)は無投薬群のBIOで減少していたが高親和性受容体の減少が主であった。メトプロロール投与によりこの減少の回復が認められたが、健常ハムスターにも同様の変化が認められた。デノパミンの投与の影響はBIOで総数では統計上有意差は認められなかったが、高親和性部は有意に増加していた。解離定数はメトプロロール投与群のBIOの高親和性部で増大しており親和性の低下が認められた(F1B7.5nM±1.2vs BIO17.1±3.1,p<.05)。そのほかの解離定数に関しては有意差は認められなかった。 アデニル酸シクラーゼ活性(表1)はGpp(NH)p,イソプロテレノール,NKHの各薬剤により刺激したところ、メトプロロール投与群でF1B,BIOともに無投薬の群に比べて有意に亢進していた。F1Bでの反応の増加が顕著でBIOと比較しても有意であった。デノパミン投与の影響はF1Bでは明らかではなく、BIOでの上昇が有意であった。基礎の活性値で補正した比を検討すると同様の傾向であったが、無投薬群のBIOをNKHで刺激したときの値の低下が認められた(Control:F1B 5.88±0.64vsBIO4.30±0.12,p<.05)。 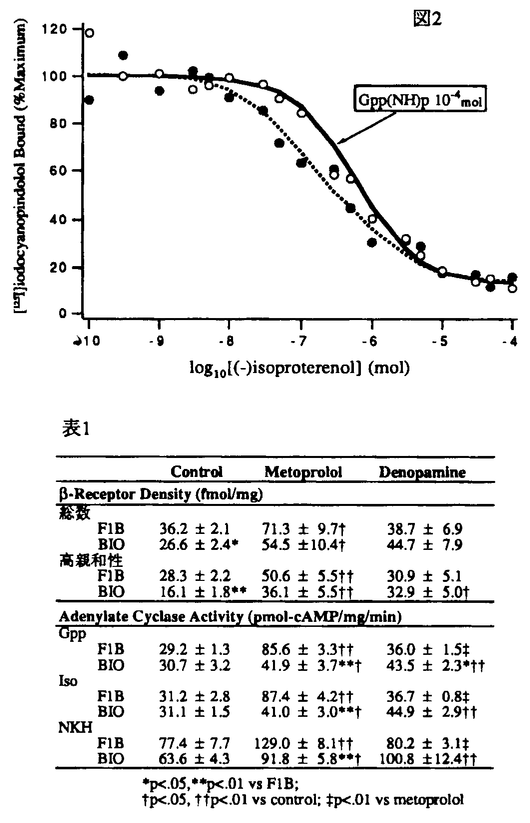 図表図2 / 表1 図表図2 / 表1 ラット群:片腎の摘出とDOCの投与により血圧は有意に上昇し(Control 127mmHg±6vsDOC195±14,p<0.01)、心重量-体重比(Control1.71mg/g±0.05vs DOC 2.52±0.14,p<0.01)の増加も認められた。しかし、 受容体(数・解離定数)およびアデニル酸シクラーゼ活性には両群間には差が認められなかった。 受容体(数・解離定数)およびアデニル酸シクラーゼ活性には両群間には差が認められなかった。 【考察】 心筋症ハムスターは8週齢より12週間にわたり薬剤を投与した。心筋症ハムスターは6週齢頃には心筋の局所病変が出現しはじめ、7,8週目頃から肥大、拡大がはじまるといわれている。本研究に用いた心筋症ハムスターは心筋病変がはじまる初期から心不全の初期の段階にかけて薬剤を投与してその影響を検討したことになる。  受容体は刺激薬を用いた結合実験で置換曲線を解析して生理的な 受容体は刺激薬を用いた結合実験で置換曲線を解析して生理的な 作用を発現する高親和性受容体の検討を行った。本研究で、BIOで認められたdown regulationは高親和性部位が主であった。メトプロロールでは予想されたようにこの 作用を発現する高親和性受容体の検討を行った。本研究で、BIOで認められたdown regulationは高親和性部位が主であった。メトプロロールでは予想されたようにこの 受容体数の減少は回復したが、やはり、高親和性のものが中心であった。また、 受容体数の減少は回復したが、やはり、高親和性のものが中心であった。また、 遮断薬による"up regulation"は 遮断薬による"up regulation"は 受容体の減少のないF1Bで認められ、有意差はなかったがF1Bの方が増加の程度も大きな傾向があった。アデニル酸シクラーゼはF1BでBIOより統計的に有意に活性が亢進していた。これは臨床的には大量の 受容体の減少のないF1Bで認められ、有意差はなかったがF1Bの方が増加の程度も大きな傾向があった。アデニル酸シクラーゼはF1BでBIOより統計的に有意に活性が亢進していた。これは臨床的には大量の 遮断薬を急激に中止したときにしばしば認められるカテコラミンに対する過剰反応のwithdrawal現象に相当するものではないかと考えられる。BIOとF1Bでは統計的には 遮断薬を急激に中止したときにしばしば認められるカテコラミンに対する過剰反応のwithdrawal現象に相当するものではないかと考えられる。BIOとF1Bでは統計的には 受容体数では差がなかったので、BIOのアデニル酸シクラーゼ活性はF1Bと比較して相対的に低下していたと考えられる。この原因の一つとして、BIOの高親和性受容体の親和性が低下していたことがあげらる。 受容体数では差がなかったので、BIOのアデニル酸シクラーゼ活性はF1Bと比較して相対的に低下していたと考えられる。この原因の一つとして、BIOの高親和性受容体の親和性が低下していたことがあげらる。 遮断薬が存在すると見かけ上 遮断薬が存在すると見かけ上 受容体の親和性が低下するが、これと同様の傾向が認められ、カテコラミンによる刺激を緩和している可能性が示唆された。 受容体の親和性が低下するが、これと同様の傾向が認められ、カテコラミンによる刺激を緩和している可能性が示唆された。 一方、刺激薬であるデノパミンの投与はF1Bにはまったく影響を与えず、またBIOのdown regulationを増強せず、むしろ高親和性受容体数を増加し、アデニル酸シクラーゼ活性も亢進した。これは、デノパミン自体に交感神経活性が亢進している場合に投与すると抑制作用を示す部分的刺激薬としての性格も影響していると思われる。また、刺激薬の投与は内因性交感神経活性を抑制する可能性もあり、 刺激薬の 刺激薬の 受容体に与える影響は薬剤により、また量により結果が異なる可能性も示唆されている。 受容体に与える影響は薬剤により、また量により結果が異なる可能性も示唆されている。 DOCと片腎摘出、塩分負荷による肥大心ラットの作製は血圧、心重量の結果からは十分であると思われたが、 受容体-アデニル酸シクラーゼ系にはまったく変化が認められなかった。他の文献から、本研究に相当するラットの灌流心の実験では心機能の低下が認められず、したがって、 受容体-アデニル酸シクラーゼ系にはまったく変化が認められなかった。他の文献から、本研究に相当するラットの灌流心の実験では心機能の低下が認められず、したがって、 受容体数の心不全時に認められるdown regulationは起こらなかったと考えられる。また、肥大心の成立過程に 受容体数の心不全時に認められるdown regulationは起こらなかったと考えられる。また、肥大心の成立過程に 受容体がなんらかの役割を果たしているという傍証も得られなかった。 受容体がなんらかの役割を果たしているという傍証も得られなかった。 【結語】  受容体を高親和性受容体の受ける影響を中心に検討したが、メトプロロールでは健常ハムスターでも受容体数の増加が認められ、BIOで見られた"up regulation"よりも顕著であり、BIOでは増加の程度が抑制されていた。親和性の低下も認められ、カテコラミンの刺激を緩衝し 受容体を高親和性受容体の受ける影響を中心に検討したが、メトプロロールでは健常ハムスターでも受容体数の増加が認められ、BIOで見られた"up regulation"よりも顕著であり、BIOでは増加の程度が抑制されていた。親和性の低下も認められ、カテコラミンの刺激を緩衝し 遮断薬の心不全治療に有効に作用している可能性が考えられた。刺激薬のデノパミンは本研究の段階の心不全では 遮断薬の心不全治療に有効に作用している可能性が考えられた。刺激薬のデノパミンは本研究の段階の心不全では 受容体系の抑制はなく、臨床上、耐性の出現に対して有利ではないかと思われた。 受容体系の抑制はなく、臨床上、耐性の出現に対して有利ではないかと思われた。 |