クモ膜下出血(以下、SAH)後に発生する遅発性脳血管攣縮(以下、スパズム)による脳虚血はSAH患者の予後を大きく左右する重大で未解決の課題である。スパズムは脳動脈の持続的収縮や内膜の肥厚などを含む複雑な病態であると考えられている。これらのうち脳動脈収縮の主原因物質として、セロトニン、ノルアドレナリン、oxyhemoglobin、アラキドン酸代謝産物などについて検討がなされてきたが、いずれも単独でスパズムの原因物質なりうるとは考えられていない。一方,1988年にブタ大動脈培養内皮細胞の培養上清から発見されたendothelin-1(以下、ET-1)は強力かつ持続的な血管収縮物質であり、発見当初からスパズム発生への関与について注目されてきた。これまでに、スパズムを伴うSAH患者で血漿中あるいは髄液中のET-1が増加していること、実験SAHにおいて動脈壁内のET-1が増加していることが発表されており、これらの所見はスパズムの発生におけるET-1の関与を示唆するものといえる。Endothelinの受容体としては、ET-1およびET-2に結合親和性の高いETAと3種の同族体に対しほぼ同等の親和性を示すETBの2種類が知られており、血管収縮においては主としてETA受容体が関与するものと考えられている。今回の研究では、イヌのSAHモデルにおける晩期脳底動脈収縮に対する、ETA受容体拮抗剤(BQ-123及びBQ-485)の予防効果を検討した。また、ETA受容体拮抗剤の効果を考えるとき、受容体自体の変化についで検討を加えておくことはさらに重要であろう。抗体が未開発のため受容体を直接測定することはできないが,同様にイヌSAHモデルを作成して脳底動脈を摘出しETA受容体mRNA発現の時間的経過を観察した。 [ETA受容体拮抗剤] 今回の実験に使用したETA受容体拮抗剤、BQ・485およびBQ-123は、それぞれ放線菌Streptomyces misakiensisの培養培地から単離されたETA受容体拮抗剤BE-18257BとBE-18257Aの構造から誘導されたもので、BQ-123はD-アミノ酸を含む5アミノ酸残基の環状ペプチド(分子量610.8)(次頁図1(a))、BQ-485は7員環の修飾側鎖を持つアミノ酸3残基のペプチド(分子量612.6)(同(b))である。BQ-485のETA受容体とETB受容体に対するET-1結合の阻害活性IC50値は3.4×10-9Mと26×10-6M、BQ-123はそれぞれ7.3×10-9Mと18×10-6Mで、ともにETA受容体に対し103倍以上の親和性を持っている。これらの拮抗剤は、摘出ブタ冠動脈のET-1による収縮を用量依存性に抑制し、またラットでのET-1靜注による初期の一過性降圧反応に影響することなく、続く昇圧反応を著明に抑制する。 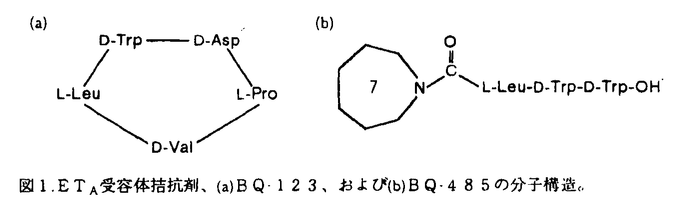 図1.ETA受容体拮抗剤、(a)BQ-123、および(b)BQ-485の分子構造。[実験1-1] 図1.ETA受容体拮抗剤、(a)BQ-123、および(b)BQ-485の分子構造。[実験1-1] 基礎実験として、in vivoでのETA受容体拮抗剤の脳血管に対する作用を確認するために、合成ET-1をイヌ大槽内に投与しその作用に対するBQ-123前投与の効果を検討した。生理食塩水を前投与した対照群(n=8)では、ET-1 10-10molの大槽内投与により著明な血圧上昇と呼吸抑制をきたし(図2(a))、脳底動脈はET-1投与前の57.4%に収縮した。BQ-123 10-7molの前投与は、ET-1大槽内投与による血圧上昇及び呼吸抑制を完全に抑制し(同(b))、脳底動脈の収縮に対しても有意の予防効果を認めた(81.3%,p<0.01,n=6)。一方、対照群の一部においてBQ-123 10-7molの後投与を行ったが、脳底動脈径の拡張は有意でなかった。 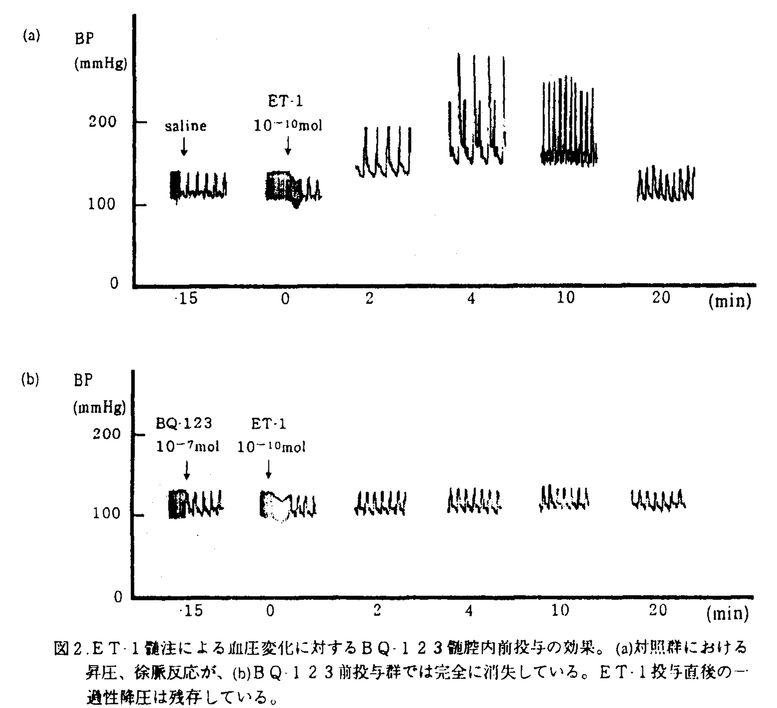 図2.ET-1髄注による血圧変化に対するBQ-123髄腔内前投与の効果。(a)対照群における昇圧、徐脈反応が、(b)BQ-123前投与群では完全に消失している。ET-1投与直後の一過性降圧は残存している。[実験1-2] 図2.ET-1髄注による血圧変化に対するBQ-123髄腔内前投与の効果。(a)対照群における昇圧、徐脈反応が、(b)BQ-123前投与群では完全に消失している。ET-1投与直後の一過性降圧は残存している。[実験1-2] 2回出血法によるイヌSAHモデルを用いて、脳底動脈狭小化に対するETA受容体拮抗剤BQ-485持続全身投与の予防効果を検討した。実験SAH作成の2日前に薬液を含む小型浸透圧ポンプを皮下に埋め込んだ。BQ-485投与群(n=9)では2×10-4mol/日を全身投与、対照群(n=6)では生理食塩水のみを投与した。自家動脈血0.4ml/kgを2日間隔で大槽内注入して実験SAHを作成し、初回の注入前とDay7に椎骨動脈撮影を行って脳底動脈径を測定した。脳底動脈径は対照群で59.9%に収縮したのに対し、BQ-485投与群での収縮は75.0%にとどまった(p<0.01)。 [実験1-3] 2回出血法によるイヌSAHモデルを用いて、脳底動脈狭小化に対するETA受容体拮抗剤BQ-123持続髄腔内投与の予防効果を検討した。実験SAH作成の2日前に動物の大槽に2本のシリコンチューブを挿入した。一方は皮下に埋め込んだ小型浸透圧ポンプに接続、他方は体外に導出してSAH作成用とした。浸透圧ポンプは対照群(n=5)で生理食塩水のみを、薬物投与群ではBQ-123を含み、後者のうち低用量群(n=7)が10-6mol/日、高用量群(n=7)は5×10-6mol/日の投与量となるように設定した。実験1-2と同様にSAHを作成し脳底動脈径を測定した。脳底動脈は対照群で70.7%に収縮したのに対し、BQ-123低用量群では79.3%と有意差を認めなかったが、高用量群では97.6%とほぼ完全な収縮の抑制を示した(p<0.05)。 [実験2] ノーザンブロット法を用いてイヌ実験SAHにおける脳底動脈ETA受容体mRNA発現の変化を検討した。上記の2回出血法で実験SAHを作成し、Day 3(n=7)とDay7(n=7)にそれぞれ動物を屠殺して脳底動脈を摘出した。対照動物の脳底動脈も採取した(n=6)。それぞれからtotal RNAを調製し、同一量をアガロースゲル上で電気泳動してニトロセルロース膜上に移し取った。一方、イヌ心筋からcDNAライブラリを作成し、これに対して他動物種の既知のETA受容体cDNA配列から設計したプライマーを用いてPCR反応を行い、プローブcDNAを合成した。本cDNAの塩基配列はラットA10培養平滑筋細胞のETA受容体cDNA配列と酷似しており、プローブとして妥当であると考えられた。プローブcDNAを標識して上記のmRNAに対するノーザンブロットを行った。使用したRNA量の指標としては -actinに対するノーザンを行った。Positive controlとしてはイヌ心筋mRNAのETA受容体cDNAに対するノーザンを行い、検出バンド位置の示標とした。対照群ではETA受容体mRNAはほとんど発現していないが、Day 3で明らかに発現が増加しており、Day 7でも少量が認められた(前頁図3)。 -actinに対するノーザンを行った。Positive controlとしてはイヌ心筋mRNAのETA受容体cDNAに対するノーザンを行い、検出バンド位置の示標とした。対照群ではETA受容体mRNAはほとんど発現していないが、Day 3で明らかに発現が増加しており、Day 7でも少量が認められた(前頁図3)。 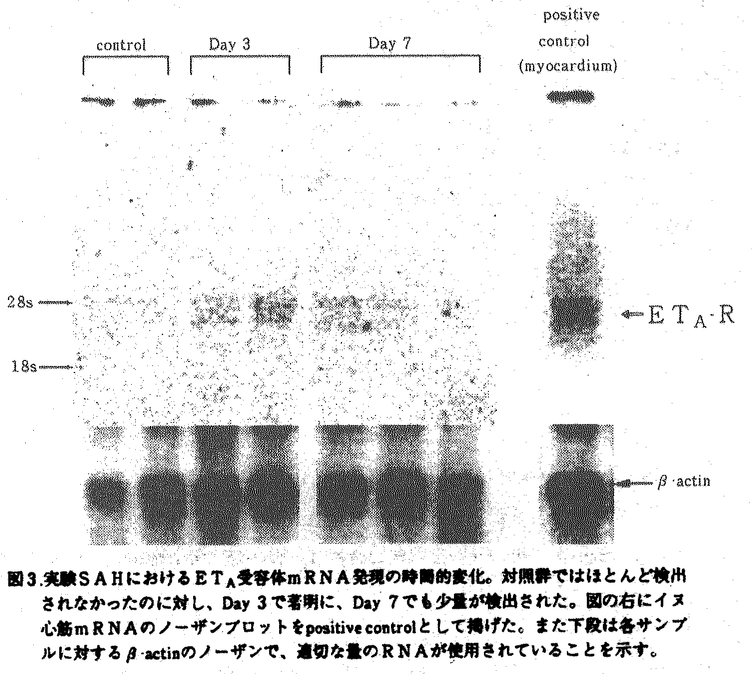 図3.実験SAHにおけるETA受容体mRNA発現の時間的変化。対照群ではほとんど検出されなかったのに対し、Day 3で著明に、Day 7でも少量が検出された。図の右にイヌ心筋mRNAのノーザンブロットをpositive controlとして掲げた。また下段は各サンプルに対する 図3.実験SAHにおけるETA受容体mRNA発現の時間的変化。対照群ではほとんど検出されなかったのに対し、Day 3で著明に、Day 7でも少量が検出された。図の右にイヌ心筋mRNAのノーザンブロットをpositive controlとして掲げた。また下段は各サンプルに対する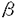 -actinのノーザンで、適切な量のRNAが使用されていることを示す。[考察] -actinのノーザンで、適切な量のRNAが使用されていることを示す。[考察] ET-1は極めて強力かつ持続的な血管収縮作用を有し、SAH後のスパズムの原因の一つとして研究が進められている。文献的にはSAH後に血中、髄液中、あるいは血管壁中のET-1が増加していることが示されており、今回の研究もそこからの発想で計画したものであった。今回の実験で、髄腔内に前投与されたETA受容体拮抗剤がET-1髄注による脳底動脈の収縮を抑制するが後投与の効果は乏しいこと、全身または髄腔内に持続投与されたETA受容体拮抗剤が実験SAHにおける脳底動脈収縮を予防すること、および実験SAHの早期においてETA受容体mRNAの発現が増加していることが示された。それらの示すところは以下のごとくであろう。 SAH後に、ET-1が増加しているかどうかは別として、脳血管においてETA受容体の増加により対ET-1感受性が亢進しており、ETA受容体拮抗剤はその状態をブロックすることによりスパズムな発生を抑制したものと考えることができる。文献上実験SAH後にET-1による脳底動脈の収縮が増強していることもこのような考えを支持するものであろう。ただし、実験1-1の結果が示すように、ETA受容体拮抗剤の効果はその投与がET-1の作用に先立つのでなければその効果は不十分であった。すなわち、ETA受容体の増加がSAH後の比較的早期に生じることを考慮に入れると、ETA受容体拮抗剤を臨床で使用する場合にSAH発症後できるだけ速やかに投与を開始する必要があることになる。 以上の結果をふまえて、スパズムの病態生理について以下のごとき仮説を立てることができるであろう。正常な血管においてはET-1、NO、prostacyclinsなどの内皮細胞由来の血管作動性物質がバランスよく作用して血管トーヌスを調節しているものと考えられる。SAH後の血管では内皮細胞障害が観察されており血管平滑筋弛緩が障害されていると考えられるのに対し、以下に述べるようにET-1が増加していると推測される。近年、血管内皮細胞のみならず、血管平滑筋細胞や大食細胞もET-1を産生することが知られている。大食細胞はSAH後の血管外膜周囲にしばしば観察される。SAHの血腫にはthrombinや oxyhemoglobinが大量に含まれており、これらはET-1産生を促進する働きがあるとされている。スパズムの発生病理において炎症反応の関与にも注目が集まっており、IL-1などのサイトカイン類もET-1産生を促進することが知られている。また、SAH直後に内皮細胞が受ける血行動態的なずり応力が増加すると考えられており、このような機械的刺激もET-1産生を増加させると考えられている。ET-1が増加していれば血管内皮に対し負のフィードバックがかかり、弛緩因子が増量するのが生理的であるが、内皮障害下ではそのような働きは低下しているであろう。またET-1が増加した場合、平滑筋細胞においてdown regulationが起こりET-1に対する反応性が下がればよいが、今回の実験が示すようにETA受容体の合成は亢進しており逆にup-regulationがかかった状態で平滑筋細胞のET-1に対する反応は過敏となっていることが予測される。以上から、SAH後にはET-1増加と脳血管平滑筋細胞の対ET-1過敏性の両方が生じており、これらがスパズム発生の主たる原因足りうるとおもわれる。このような病態においてETA受容体拮抗剤は脳血管平滑筋に対するET-1の作用を抑制するものであり,これまで決定的な治療法の存在しなかったスパズムを根本的に解決しうる手段としてより詳細な検討が必要である。 |