本論文は、スピカマイシンの化学修飾と抗腫瘍活性、及び絶対立体配置の決定に関するもので五章よりなる。 第一章では、スピカマイシン誘導体合成に至る経緯について述べる。 第二章では、スピカマイシンの脂肪酸部分の誘導体の合成と、その抗腫瘍活性について述べる。 第三章では、スピカマイシンのアミノ酸部分の化学修飾と、その抗腫瘍活性及び、蛋白合成阻害活性について述べる。 第四章では、スピカマイシンの糖部分及び、アデニン部分の化学修飾とその抗腫瘍活性について述べる。 第五章では、スピカマイシンの絶対立体配置の決定について述べる。 第一章スピカマイシン誘導体合成の経緯 スピカマイシン[1]は、早川らにより放線菌Streptomyces alanocinicus 879-MT3の培養液より、ヒト骨髄性白血病細胞、HL60に対する分化誘導物質として単離され、  アミノ糖部分の6’位の立体化学及び、絶対立体配置は不明であるが、その構造は[1]であると報告されている。スピカマイシン[1]は、脂肪酸部分、グリシン部分、アミノ糖部分、アデニン部分の4個の部分構造からなり、微生物培養液からは脂肪酸部分が炭素数12-18の直鎖もしくは末端が分岐した形の飽和脂肪酸の混合物として得られる。上正原らは、ヌードマウス・ヒト移植腫瘍系にヒト胃癌(SC-9)を用いた評価において、スピカマイシン[1]に抗腫瘍効果を認め、なかでも炭素数12の直鎖飽和脂肪酸を有する天然物中の1組成物[SPM VIII,2]が最も強い抗腫瘍効果を示すことを報告している。しかしながら、薬効域と毒性との分離を示す、治療係数は4であり、より治療係数の高い誘導体が望まれていた。また、スピカマイシン[1]は、癌細胞の蛋白合成を阻害することにより殺細胞効果を示すことも報告されており、更に無細胞系での蛋白合成阻害試験及び、ラベル体を用いた細胞への取り込み、及び細胞内でのスピカマイシンの代謝の検討により、細胞内で脂肪酸部分が変換酵素により加水分解されて、SAN-Gly[4]となり、この物質が蛋白合成を阻害することも明らかにされている。 そこで著者は、このスピカマイシンの特異な構造と抗腫瘍活性に着目し、固型癌に対してより高い活性を有する誘導体を得ることを目的としてスピカマイシンの化学修飾を行ない、それら誘導体の抗腫瘍活性について検討した。 第二章スピカマイシンの脂肪酸部分の化学修飾と抗腫瘍活性 スピカマイシン[1]の脂肪酸部分を、種々の置換基を有する脂肪酸を用いて化学修飾を行い123種の誘導体を合成した。これらの誘導体は、スピカマイシンを加水分解して得ることができるスピカマイシンアミノヌクレオシド[SAN,3]を原料として合成 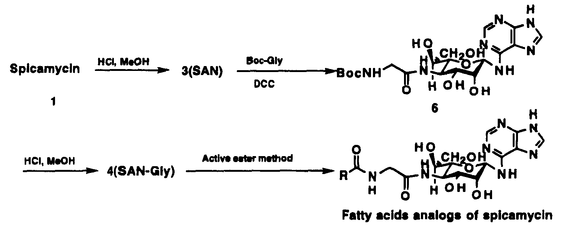 した。まずアミノ基を保護したグリシンとSANとを縮合し[6]を得た後、脱保護して4’-N-グリシルスピカマイシンアミノヌクレオシド[SAN-Gly,4]を得た。次にSAN-Gly[4]と各種脂肪酸の活性エステル、もしくは直接脂肪酸と縮合剤を用いてアミド化反応を行ない合成した。合成したこれら123種の誘導体についてヌードマウス・ヒト移植腫瘍系(in vivo)においてヒト大腸癌(COL-1)を用いて評価し脂肪酸部分と活性との相関について検討した。その結果、in vivoにおける抗腫瘍活性に関して親化合物であるSPM VIII[2]と比較してより高い活性を有する誘導体を16種得ることができた。特に脂肪酸部分の , , ; ; , , 位に2個の二重結合を持つ化合物群で炭素数12,14の誘導体がSPM VIII[2]の4倍の治療係数を示した。また、一連の誘導体の評価結果から、脂肪酸部分の脂溶性と抗腫瘍活性が強い相関を有することが示された。また、2位置換基の立体化学とその嵩高さが活性に大きく影響すること、およびグリシンをアルキル化した誘導体には活性がないことから、グリシンと脂肪酸間のアミド結合部分が抗腫瘍活性の発現に深く関与していることが示され、この結果は、SAN-Gly[4]が活性本体であることを支持するものであった。 位に2個の二重結合を持つ化合物群で炭素数12,14の誘導体がSPM VIII[2]の4倍の治療係数を示した。また、一連の誘導体の評価結果から、脂肪酸部分の脂溶性と抗腫瘍活性が強い相関を有することが示された。また、2位置換基の立体化学とその嵩高さが活性に大きく影響すること、およびグリシンをアルキル化した誘導体には活性がないことから、グリシンと脂肪酸間のアミド結合部分が抗腫瘍活性の発現に深く関与していることが示され、この結果は、SAN-Gly[4]が活性本体であることを支持するものであった。 第三章スピカマイシンのアミノ酸部分の化学修飾と生物活性 SAN-Gly[4]のアミノ酸部分の構造と蛋白合成阻害活性との相関を検討するため、SAN[3]と、アミノ基が保護されたアミノ酸とを縮合した後、脱保護することにより、グリシン部分が他のアミノ酸に置換した誘導体[SAN-AA]を21種合成し、それらを 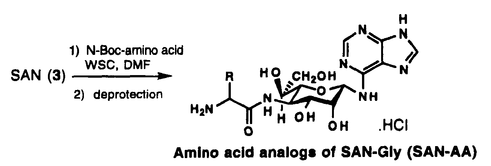 ウサギの網状赤血球を用いた無細胞系における蛋白合成阻害試験にて評価した。SAN[3]に結合したアミノ酸の中では、グリシンが最も蛋白阻害活性が高く、これを他のアミノ酸に変換すると活性が低下した。また、SAN-AAの蛋白合成阻害活性と、SAN-AAにドデカン酸がアミド結合した誘導体のin vivoでの抗腫瘍活性との間に、相関が認められる傾向にあった。 第四章スピカマイシンの糖部分およびアデニン部分の化学修飾と抗腫瘍活性 SPM VIII[2]の糖部分の水酸基をアセチル化した誘導体、および6’,7’-O-ベンジリデン誘導体は、全て活性の著しい低下が認められた。糖の6’,7’位を開裂させて合成した、ヘキソース誘導体には活性が認められた。以上の結果から、スピカマイシンの糖部分の水酸基を、アシル化もしくはアルキル化することにより活性が著しく低下することが判明した。 スピカマイシンのアデニン部分の9位のNHに置換基を導入した誘導体を合成した。これらの誘導体ををin vivoの系で評価したところ、全て活性が著しく低下した。アデニン部分の9位のNH部分は活性の発現に極めて重要な関与をしていることが判明した。 第五章スピカマイシンの絶対立体配置の決定 スピカマイシンアミノヌクレオシド[SAN,3]の結晶を用いてX線結晶構造解析を行ない、糖部分の相対立体配置を決定した。また、SANを加水分解して得たアミノ糖の3’位の水酸基と4’位のアミノ基の間の絶対立体配置をTACu(テトラアンミンカッパー(II)サルフェート)法を用い3’R,4’Sと決定した。以上の結果から、SAN[3]の構造を6-(4-amino-4-deoxy-L-glycero- -L-manno-heptopyranosylamino)-9H-purineと決定した。 -L-manno-heptopyranosylamino)-9H-purineと決定した。 以上、スピカマイシン誘導体を各種合成しその構造活性相関を次図のように明らかにした。  図表 図表 本スピカマイシン誘導体合成研究で見い出した、脂肪酸部分の , , ; ; , , 位に2個の二重結合を持つ炭素数14の誘導体[KRN5500,5]は強い抗腫瘍活性を有し現在開発が進められている。 位に2個の二重結合を持つ炭素数14の誘導体[KRN5500,5]は強い抗腫瘍活性を有し現在開発が進められている。 |