細胞が機能を維持していくためには、絶えず細胞内の必要な場所に必要とされる物質が供給されることが不可欠である。この細胞内物質輸送の研究には神経細胞は理想的な系として用いられる。神経細胞は時には数メートルに及ぶ長い軸索を持つ。軸索内では蛋白合成はほとんど行なわれず、蛋白やミトコンドリア、シナプス小胞の前駆体などは細胞体で作られた後に順方向性の軸索輸送により神経末梢へ運ばれる。また神経末端で取り込まれた物質や不用となった物質は反対に細胞体へと運ばれ、この逆行性の軸索輸送が神経末端での情報を細胞体へ提供することにもなる。 軸索輸送は50-100mm/日の速いものと、0.2-8mm/日の遅いもののふたつに大別される。遅い軸索輸送では細胞骨格成分と可溶性蛋白が順行性に運ばれるが、この輸送機構は解明が遅れている。速い軸索輸送は、物質が膜小器官に取り込まれ、この膜小器官が微小管をレールとして運ばれるもので、順行性と逆行性の両者が知られている。VE-DIC顕微鏡(ビデオエンハンスト微分干渉顕微鏡)の開発によりこの軸索輸送の様子が光学顕微鏡下で生きたまま観察できるようになったため、その研究は急速に進みつつある。近年、キネシンと細胞質ダイニンという二種類のモーター蛋白が、それぞれ順行性と逆行性の速い軸索輸送のモーターの候補として神経組織から精製された。これらの蛋白が実際に軸索内において膜小器官輸送のモーターとして働いていることを確認するため、私達はまず次の実験を行なった。 ラット末梢神経を結紮し、結紮の近位側に順行性に運ばれる膜小器官を、遠位側に逆行性に運ばれる膜小器官を蓄積させた。そして免疫染色を行なったところ、キネシンは主として順行性に運ばれる膜小器官に結合し、細胞質ダイニンは順行性と逆行性の双方の膜小器官に結合していることが解った。この結果はキネシンおよび細胞質ダイニンが膜小器官輸送のそれぞれ順行性および逆行性のモーターとして働いていることを裏付けるとともに、次の新しいふたつの問題を提供する。第一にキネシンが神経末端において膜小器官から遊離されるのはどのような機構によるのだろうか。第二に細胞質ダイニンは順行性に運ばれている間は不活性化されているのだろうか。 この第一の疑問に答えるため、私達はキネシンおよびシナプス小胞をラット脳より精製し、その結合をin vitroで調べた。キネシンはシナプス小胞に濃度依存性に結合し、解離定数は18nM、最大結合容量は1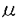 gシナプス小胞に対して53fmolと求められた。キネシンを前もってAキナーゼでリン酸化しておくと、シナプス小胞への結合は半減した。次にVE-DIC顕微鏡を用いてキネシンを結合させたシナプス小胞が精製微小管に沿って動くことを観察したが、キネシンをリン酸化することによって動くシナプス小胞の数は半減した。最後にキネシンを結合したシナプス小胞を精製微小管と混ぜてネガティブ染色を行なったところ、ここでもキネシンのリン酸化によってシナプス小胞のキネシンを介した微小管への結合が半減した。これらのデータは全て、キネシンがAキナーゼでリン酸化されることによって、その膜小器官への結合能が低下することを示す。これと前回の結果を合わせ、私達は以下の仮説をたてた。 gシナプス小胞に対して53fmolと求められた。キネシンを前もってAキナーゼでリン酸化しておくと、シナプス小胞への結合は半減した。次にVE-DIC顕微鏡を用いてキネシンを結合させたシナプス小胞が精製微小管に沿って動くことを観察したが、キネシンをリン酸化することによって動くシナプス小胞の数は半減した。最後にキネシンを結合したシナプス小胞を精製微小管と混ぜてネガティブ染色を行なったところ、ここでもキネシンのリン酸化によってシナプス小胞のキネシンを介した微小管への結合が半減した。これらのデータは全て、キネシンがAキナーゼでリン酸化されることによって、その膜小器官への結合能が低下することを示す。これと前回の結果を合わせ、私達は以下の仮説をたてた。 キネシンは細胞体で膜小器官に結合して神経末端までこれを輸送する。この際に細胞質ダイニンも膜小器官に結合した状態で受動的に運ばれていると考えられる。神経末端ではAキナーゼが豊富に局在しているため、キネシンはリン酸化を受け膜小器官から遊離する。そして残った細胞質ダイニンが膜小器官を今度は細胞体へと運ぶのであろう。 次の段階としてこの仮説をin vivoで裏付ける必要があるが、私達は既にザリガニの巨大軸索にAキナーゼを投与することにより小さな膜小器官の順行性の輸送が特異的に抑制されることをVE-DICシステムを用いて観察している。このようにin vitro再構成系の実験と軸索輸送の直接の観察の組合せにより速い軸索輸送の方向の調節機構を、他のリン酸化酵素、モーター蛋白、そしてモーター結合蛋白との関連をも含めて今後も解明していきたい所存である。 さて、細胞内の微小管には膜小器官輸送のレールとしての役割の他に、細胞の形態の形成と維持というもうひとつの重要な役割がある。神経細胞は一本の細く長い軸索と枝分かれの多く末端へいくに従って細くなる樹状突起とを持ち、明確な極性を有するために、微小管と細胞の形態という面からもよく研究されている。神経突起内では微小管は豊富に束を形成しながら走行する。微小管束の中で微小管同志の間には細長い架橋構造が観察されるが、これらの架橋構造を形成しているのが一群の微小管関連蛋白である。 微小管関連蛋白では神経組織に多いMAP1A、MAP1B、MAP2、およびtau、そして広範囲の組織に存在するMAP4がよく研究されている。これらの蛋白のうち私達はMAP1Bについて詳しい解析を行なった。まずモノクローナル抗体を作製し、これを用いてMAP1Bをブタ脳からアフィニティー精製した。精製MAP1Bは約320kDaの分子量の蛋白で微小管と結合する能力を持つ。この蛋白を低角度回転蒸着法により観察したところ、一方に直径約10nmの球状部位を持つ、長さ平均186nmの線維状蛋白であることが解った。また精製微小管と結合させたMAP1BをQuick-Freeze Deep-Etch法を用いて観察し、MAP1Bが微小管間で神経突起内にみられるのと同様の架橋構造を形成していることを認めた。さらにラット小脳を免疫染色してから電子顕微鏡で観察したところ、微小管間の架橋構造が抗MAP1B抗体でラベルされ、MAP1Bが神経突起内で微小管間の長い架橋構造の一員となっていることが証明された。抗MAP1B抗体のうちひとつは微小管結合能の強いMAP1Bのリン酸化型のみを認識し、もうひとつは全てのMAP1Bの型を認識した。ラット脳の免疫染色では前者は軸索のみを染めるのに対して、後者は軸索の他に細胞体と樹状突起をもよく染めた。軸索の染色は両者とも伸長途中の幼若なもので強かった。これらの結果は、MAP1Bが伸長途中の軸索においてリン酸化され、微小管間に架橋構造を形成して微小管を安定化し、それによって軸索の細長い形態の形成に関与していることを示唆する。 このように微小管関連蛋白による微小管修飾は形態の形成・維持の視点からは重要であるが、微小管のレールとしての役割は阻害しないのだろうか。この疑問に答えるため以下の実験を行なった。 サル線維芽細胞COS細胞は内因性の微小管関連蛋白が少なく、これに神経特異的な微小管関連蛋白を遺伝子導入し強制発現させると細胞内の微小管に結合する。正常COS細胞では膜小器官が細胞質中を微小管と考えられる線維状構造に沿って自在に行き来している様子がVE-DIC顕微鏡を用いて観察される。これに神経特異的な微小管関連蛋白であるMAP2Cおよびtauを強制発現させて、膜小器官の動きを正常COS細胞と比較したところ、MAP2Cを強制発現させたCOS細胞では約20%、tauを強制発現したCOS細胞では約10%にまで動きは抑制された。またMAP2Cとtauの微小管結合部位のみを強制発現させた細胞でも動きは正常COS細胞と比べてそれぞれ約40%と約20%に抑制され、この抑制が微小管関連蛋白の線維状架橋構造による立体障害によってだけでは説明しがたい事を示した。むしろ原因としては以下の二つの理由が考えられる。第一にモーター分子と微小管関連蛋白が微小管上の結合部位を共有するために、微小管関連蛋白で飽和した微小管表面にモーター分子が結合できないという理由。第二にモーター分子が微小管に結合するためには微小管の負電荷が必要であり、微小管関連蛋白がこの電荷を打ち消すためにモーター分子が微小管に結合できなくなると言う理由である。 この原因を考察するために私達はさらにin vitroの結合実験を行った。そしてin vitroでも微小管関連蛋白とモーター分子の微小管結合は競合し、その原因は上述の第一の原因によるものことを確認した。 さて、in vivoでは微小管関連蛋白はダイナミックに微小管への結合、遊離を繰り返しており、この安定性は微小管関連蛋白のリン酸化によって調節を受ける。よって膜小器官輸送の調節にも微小管関連蛋白のリン酸化が関与していることが示唆され、実際に私たちは現在、この仮説を裏付ける予備的なデータを得ているが、さらに検討を進めるためにもここで用いたCOS細胞の系は非常に有用であろう。 以上、私達は膜小器官の微小管に沿った輸送の調節機構をモーター蛋白のリン酸化および微小管の微小管関連蛋白による修飾を中心に研究してきた。この際、常にin vivoの観察とin vitroの実験とを並行し、互いに互いの結論を確認する方法で研究を進めてきた。そして輸送の研究である以上、動きを直接に眼で確認することを心がけてきた。膜小器官の輸送の研究は現在ようやく役者がそろいはじめたところで、その役割や調節はまだほとんど解明されていない。また新しいモーター蛋白やモーター結合蛋白のように、現在みつかりつつある役者も多い。今後も多種の実験系を併用し眼にみえる形で膜小器官の輸送の調節機構を研究し続けたいと希望している。 |