血小板活性化因子(platelet-activating factor;PAF)は、強力な脂質性生理活性物質であり、炎症・気管支喘息・敗血症性ショック・糸球体腎炎などさまざまな病態で役割を果たしていると考えられる。PAFの生理作用は、特異的な受容体との結合を介して発揮され、ホスファチジルイノシトール代謝回転の亢進を始め、いくつかの細胞内情報伝達機構を活性化する事が知られている。1991年、Hondaらは、発現クローニングの手法を用いてPAF受容体cDNAの単離に成功し、ついで、ヒト、ラットのホモログも単離され、これにより、PAF受容体は7回膜貫通型のG蛋白質共役型の受容体であることが明らかになった。 本研究では、このPAF受容体cDNAの変異体をCHO細胞に導入し、PAF受容体カルボキシル末端の、情報伝達機構における役割を明らかにした。まず、カルボキシル末端のアミノ酸40残基を欠失したPAF受容体を導入した細胞(Deletion mutant)では、野生型(Wild type)に比べて、IP3産生のタイムコースが遷延化する事がわかった(図1)。また、他のすべての情報伝達系(アデニル酸シクラーゼの抑制、アラキドン酸の遊離、MAPキナーゼキナーゼの活性化)においても、Deletion mutantはWild typeに比して、強くシグナルを伝えた(表)。これらの結果より、受容体のカルボキシル末端40残基は、シグナルを伝えることには関与しないが、シグナルを負に調節するのに、重要な役割を果たすことが示唆された。また、このDeletion mutantではPAFの2度目の投与による反応減弱(脱感作)が認められなかった(図2)。 次に、カルボキシル末端のリン酸化が、このようなシグナルの負の調節に寄与するのではないかという仮説のもとに、カルボキシル末端のリン酸化を受けうる残基(セリン・スレオニン残基)6つをアラニンに変えた変異体を作成した(Carboxyl terminal phosphorylation site mutant;CP mutant)。するとやはり、CP mutantにおいても、Deletion mutantと同様に、IP3産生のタイムコースの遷延化、各種情報伝達の増強が認められ、仮説が正しいことが示唆された(図1および表)。 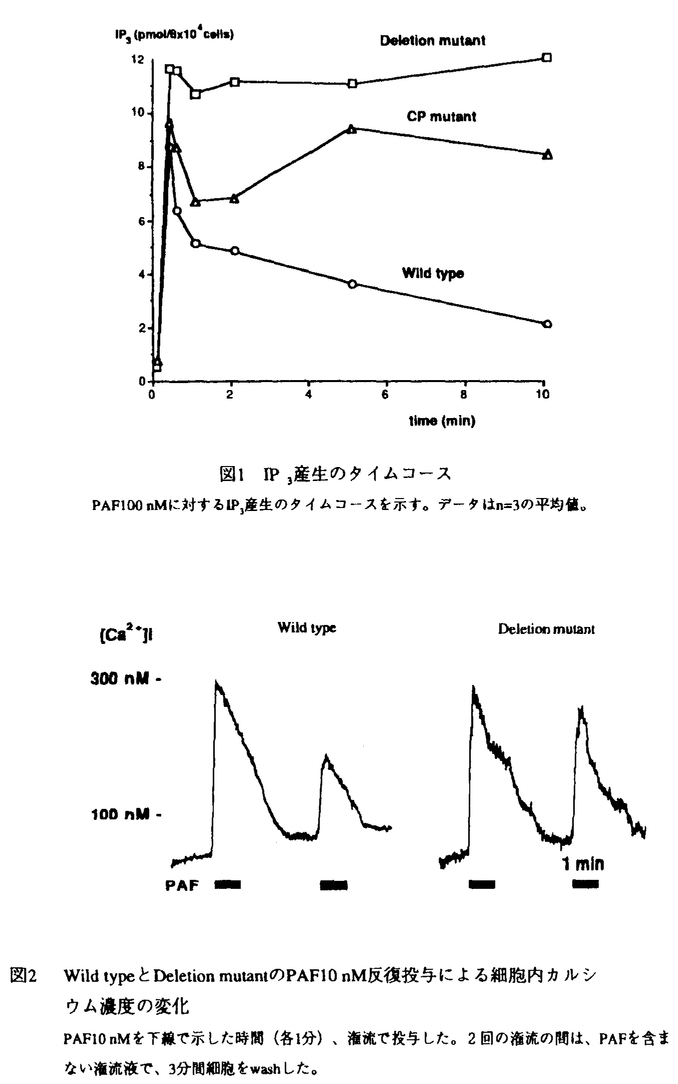 図表図1 IP3産生のタイムコース PAF100nMに対するIP3産生のタイムコースを示す。データはn=3の平均値。 / 図2 Wild typeとDeletion mutantのPAF10nM反復投与による細胞内カルシウム濃度の変化 PAF10nMを下線で示した時間(各1分)、潅流で投与した。2回の潅流の間は、PAFを含まない潅流液で、3分間細胞をwashした。 図表図1 IP3産生のタイムコース PAF100nMに対するIP3産生のタイムコースを示す。データはn=3の平均値。 / 図2 Wild typeとDeletion mutantのPAF10nM反復投与による細胞内カルシウム濃度の変化 PAF10nMを下線で示した時間(各1分)、潅流で投与した。2回の潅流の間は、PAFを含まない潅流液で、3分間細胞をwashした。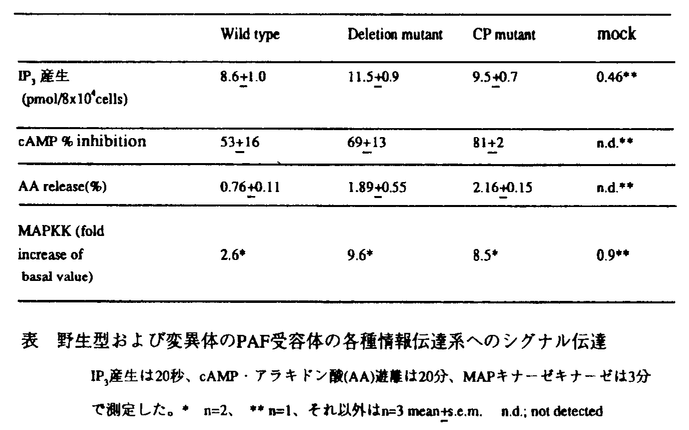 表 野生型および変異体のPAF受容体の各種情報伝達系へのシグナル伝達IP3産生は20秒、cAMP・アラキドン酸(AA)遊離は20分、MAPキナーゼキナーゼは3分で測定した。*n=2、**n=1、それ以外はn=3mean±s.e.m. n.d.;not detected 表 野生型および変異体のPAF受容体の各種情報伝達系へのシグナル伝達IP3産生は20秒、cAMP・アラキドン酸(AA)遊離は20分、MAPキナーゼキナーゼは3分で測定した。*n=2、**n=1、それ以外はn=3mean±s.e.m. n.d.;not detected このようなリン酸化を起こすキナーゼとして、プロテインキナーゼCと -adrenergic receptor kinase( -adrenergic receptor kinase( ARK)の2つを考えた。プロテインキナーゼCの阻害剤であるH7処理やホルボールエステルによるプロテインキナーゼCのdown regulationでは、IP3産生のタイムコースには変化がみられず、プロテインキナーゼCの関与は否定的であった。一方、PAF受容体カルボキシル末端のペプチドを合成し、in vitroで ARK)の2つを考えた。プロテインキナーゼCの阻害剤であるH7処理やホルボールエステルによるプロテインキナーゼCのdown regulationでは、IP3産生のタイムコースには変化がみられず、プロテインキナーゼCの関与は否定的であった。一方、PAF受容体カルボキシル末端のペプチドを合成し、in vitroで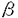 ARKとインキュペートしたところ、このペプチドは ARKとインキュペートしたところ、このペプチドは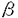 ARKのよい基質となることが判明した。現在のところ、PAF受容体を免疫沈降できる抗体が存在しないので、受容体のin vivoでのリン酸化の直接の証拠は得られていない。しかしながら、ヒト好中球で、PAF刺激により ARKのよい基質となることが判明した。現在のところ、PAF受容体を免疫沈降できる抗体が存在しないので、受容体のin vivoでのリン酸化の直接の証拠は得られていない。しかしながら、ヒト好中球で、PAF刺激により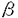 ARKのトランスロケーションが観察されるとのChuangらの報告と併せて、 ARKのトランスロケーションが観察されるとのChuangらの報告と併せて、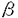 -ARKがPAF受容体のリン酸化に関与している可能性が示唆された。 -ARKがPAF受容体のリン酸化に関与している可能性が示唆された。 以上より、1)PAF受容体のカルボキシル末端の40アミノ酸残基は、異なるG蛋白質を介したいくつかの情報伝達系、すなわち、ホスホリパーゼCの活性化、アラキドン酸遊離、アデニル酸シクラーゼの抑制、MAPキナーゼキナーゼの活性化などへのシグナルの伝達には必要でない、2)しかし、その領域は、全てのシグナルを負に調節するのに必要であって、脱感作に大きく関与していると考えられる、3)この負の調節は、受容体のリン酸化を介して行われていると考えられる、4) ARK1はPAF受容体をリン酸化する可能性が高い、ことが示唆された。 ARK1はPAF受容体をリン酸化する可能性が高い、ことが示唆された。 |