G蛋白共役型受容体の構造、機能、調節機序そして病態との関連が過去数年間の分子生物学的手法に基づく研究成果により明確になってきている。このファミリーのレセプターに共通な構造上の特徴としては、N末端を細胞外にそしてC末端を細胞内に有しその間に細胞膜を7回貫通する領域とそれを連結する3個ずつの細胞内外ループを持っていること、細胞外N末端領域には糖鎖結合部位が存在し、細胞内ループと細胞内C末端領域にセリン.スレオニンキナーゼによる幾つかのリン酸化部位の存在が認められることがあげられる。血管平滑筋においては多くの血管作動物質がG蛋白共役型受容体を介してシグナルを伝達することが知られている。例えば持続的で強力な血管収縮活性に加え血管平滑筋増殖活性を有するエンドセリンはレセプターに結合した後、ホスフォリパーゼCを活性化しイノシトールリン酸を産生してこれが細胞内カルシウムイオン濃度を上昇させることが示されている。エンドセリンのレセプターはETAとETBの2種類のcDNAがクローニングされているが共に7回膜貫通型のG蛋白共役型受容体の特徴を有している。この様な血管作動性物質の産生及び分泌調節機構、受容体とその細胞内情報伝達機構の研究さらには受容体の刺激薬あるいは遮断薬を使用した研究により循環器疾患の病態生理が分子レベルで解明されつつある。しかし本態性高血圧、動脈硬化あるいは心筋梗塞に至る循環系疾患の発症機序や進展機序が解明されるためにはさらに心臓、血管をコントロールしている未知の血管作動性物質を探り出し物質レベル、分子レベルで病態解明のアプローチを行なって行くことが必要と考えられる。本研究においては多くの重要な血管作動性物質をそのリガンドとしていることが解明されつつあるG蛋白共役型受容体に着目し、血管平滑筋に発現している新たなG蛋白共役型受容体の探索を試みた。これまでにcDNAクローニングされた幾つかのG蛋白共役型受容体のシークエンスよりこれらG蛋白共役型受容体間においては特に細胞膜貫通部分のホモロジーの高いことが分かっている。そこでこのホモロジーを利用してdegenerate oligonucleotide primersを作成し、PCRとホモロジースクリーニングによりラット血管平滑筋cDNAライブラリーをスクリーニングし全長2.9Kb、1056塩基のコーディング領域を有するAGR16をクローニングした。AGR16は推定アミノ酸配列(図1)の解析により(1)7個の疎水性領域を有すること、(2)N末端領域に一つのN-linked glycosylation siteのコンセンサス配列を有すること、(3)第2および第3細胞質ループとC末端部位にセリン、スレオニンキナーゼによるリン酸化部位の認識配列を有すること、(4)多くのG蛋白共役型受容体に共通して保存されている幾つかのアミノ酸を有すること、が明らかとなった。これら構造上の特徴は、AGR16がG蛋白共役型受容体ファミリーの一員であることを強く示唆する。  図1 AGR16の核酸配列と推定アミノ酸配列(*)N-linked glycosylation部位 (・)cAMP依存性プロテインキナーゼ及びプロテインキナーゼCによるリン酸化部位 (I〜VII)推定膜貫通ドメイン 図1 AGR16の核酸配列と推定アミノ酸配列(*)N-linked glycosylation部位 (・)cAMP依存性プロテインキナーゼ及びプロテインキナーゼCによるリン酸化部位 (I〜VII)推定膜貫通ドメイン ホモロジー検索により、他のG蛋白共役型受容体とのアミノ酸配列を比較したところ(図2)ヒトの血管内皮細胞のcDNAライブラリーよりクローニングされたEDG-1が、AGR16と全長に渡って最も高いホモロジー(51%)を示した。EDG-1はその推定アミノ酸配列からG蛋白共役型受容体と推定されている蛋白であるが、リガンドは特定されていない。EDG-1以外にラットカンナビノイドレセプター(27%)とイヌアデノシンA2レセプター(24%)がAGR16と有意なホモロジーを示した。  図2 AGR16のアミノ酸レベルにおけるホモロジーデータrat cannabi,rat cannabinoid receptor dog A2,dog A2 adenosine receptor 図2 AGR16のアミノ酸レベルにおけるホモロジーデータrat cannabi,rat cannabinoid receptor dog A2,dog A2 adenosine receptor AGR16とEDG-1の間に存在する51%程度のホモロジーはサブタイプ間に匹敵する値であり、このことはAGR16とEDG-1がサブタイプの関係、つまり同じリガンドもしくは非常に類似したリガンドを結合する可能性を示唆している。 AGR16をレセプターサブファミリーとして理解するため、サブタイプの関係にあると考えられるラットのEDG-1のcDNAクローニングを試みた。ヒト血管内皮細胞よりRT-PCRによりヒトEDG-1cDNAの部分フラグメントを得、このPCR産物をプローブとしてラット肺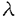 gt10cDNAライブラリーをスクリーニングし、1149塩基のラットEDG-1をコードする全長2.9Kbのクローンを単離した。推定アミノ酸配列(図3)の解析からEDG-1もAGR16と同様にG蛋白共役型受容体の特徴を有することが明らかとなった。 gt10cDNAライブラリーをスクリーニングし、1149塩基のラットEDG-1をコードする全長2.9Kbのクローンを単離した。推定アミノ酸配列(図3)の解析からEDG-1もAGR16と同様にG蛋白共役型受容体の特徴を有することが明らかとなった。  図3 EDG-1の核酸配列と推定アミノ酸配列(*)N-linked glycosylation部位 (・)cAMP依存性プロテインキナーゼ及びプロテインキナーゼCによるリン酸化部位 (I〜VII)推定膜貫通ドメイン 図3 EDG-1の核酸配列と推定アミノ酸配列(*)N-linked glycosylation部位 (・)cAMP依存性プロテインキナーゼ及びプロテインキナーゼCによるリン酸化部位 (I〜VII)推定膜貫通ドメイン ノーザンブロット解析によりラットの各臓器における発現を検討した結果(図4)、AGR16mRNAは肺、心臓、大動脈に強い発現を認め、EDG-1mRNAは大動脈と肺に最も強く発現していた。AGR16とEDG-1は共に、培養ラット大動脈平滑筋細胞、血管内皮細胞、心筋細胞に発現していた(図5)。このようにAGR16とEDG-1はともに心臓、血管系に強い発現を認めることから、二つのレセプターの重要な機能の一つが循環系の調節にあることを推定させる。またAGR16が胃、腸、副腎に強く発現しているのに対しEDG-1の発現はかなり弱く、これらの臓器における二つのレセプターの重要性は異なっているものと思われる。 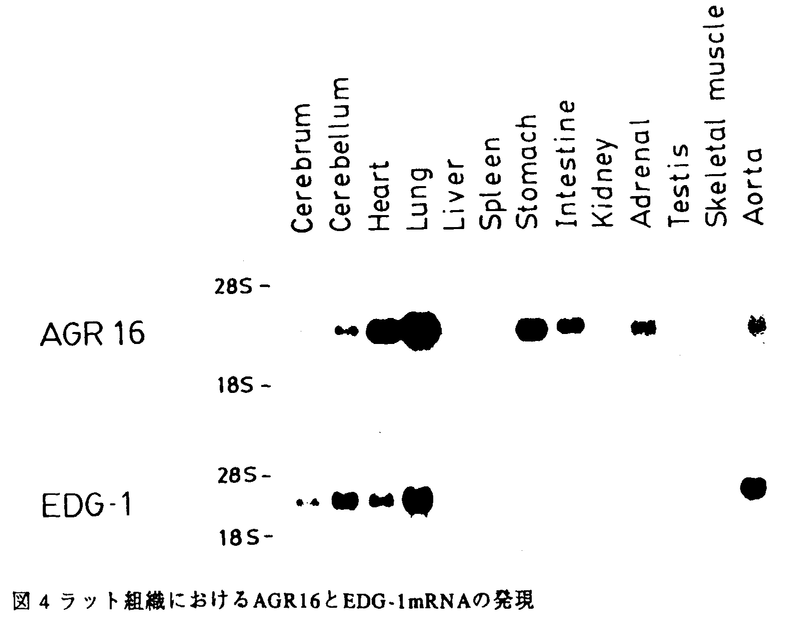 図4 ラット組織におけるAGR16とEDG-1mRNAの発現 図4 ラット組織におけるAGR16とEDG-1mRNAの発現 AGR16とEDG-1mRNAの発現調節機序を理解するため、培養ラット大動脈平滑筋細胞、血管内皮細胞、心筋細胞を用いて検討した(図5)。AGR16mRNAはサイクリックAMP産生を刺激するホルスコリン、Cキナーぜを活性化するホルボールエステル、いずれの薬物を与えても全ての細胞で何ら変化を示さなかった。EDG-1mRNAは大動脈平滑筋細胞においてホルスコリンにより上昇し、ホルボールエステルで刺激した場合にもEDG-1mRNAレベルの上昇が観察された。血管内皮細胞においてホルスコリン刺激により大動脈平滑筋細胞と同様にEDG-1mRNAレベルの上昇が観察されたが、ホルボールエステルで刺激した場合には逆に減少を示した。心筋細胞ではいずれの薬物によっても何ら変化を示さなかった。このようにEDG-1mRNAの発現調節は細胞の種類によって異なっていた。 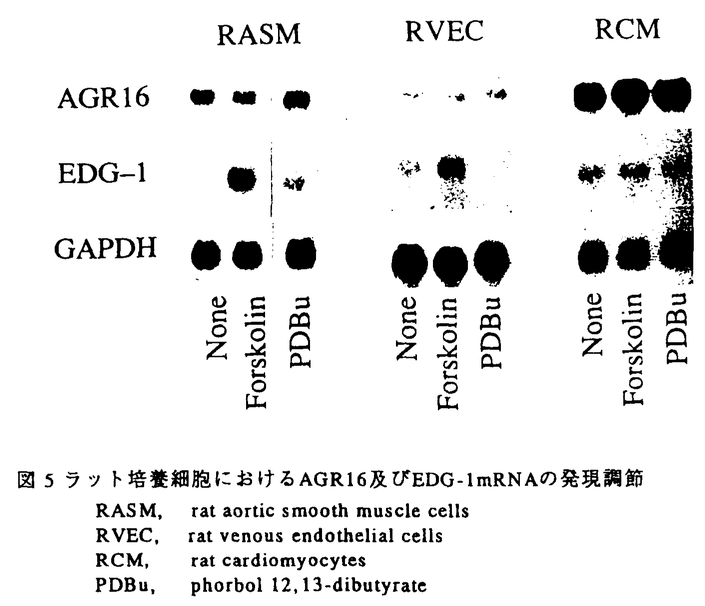 図5 ラット培養細胞におけるAGR16及びEDG-1mRNAの発現調節RASM,rat aortic smooth muscle cells RVEC,rat venous endothelial cells RCM,rat cardiomyocytes PDBu,phorbol12,13-dibutyrate 図5 ラット培養細胞におけるAGR16及びEDG-1mRNAの発現調節RASM,rat aortic smooth muscle cells RVEC,rat venous endothelial cells RCM,rat cardiomyocytes PDBu,phorbol12,13-dibutyrate AGR16とEDG-1の病態との関連を探るため二つのタイプの高血圧ラット(SHRと2腎1クリップを用いて大動脈および心におけるmRNAの発現を検討したが、いずれのモデルにおいてもコントロールラットとの差は見いだせず、現時点では疾患との関連性は不明である。 今後の研究によりリガンドが明らかになれば心、血管系をコントロールしている新たなリガンド/レセプターシステムの存在が解明されるものと思われる。 |