本研究は、血管平滑筋が産生するPDGF様物質が従来知られているPDGF-A鎖と同一であるか否かをcDNAクローニングによって解析し、これが平滑筋細胞の増殖や血管の発生段階でどのような動態を示すか、さらにPDGFとアンギオテンシン系の遺伝子発現が障害後の血管壁再構築過程でどのように変化するかを明らかにすることを目的としたものであり、下記の結果を得ている。
<実験1> 実験1においては、血管平滑筋由来のPDGF様物質と従来知られていたPDGF-A鎖との異同を明らかにし、さらに平滑筋の分化、増殖に伴って遺伝子発現がどのように変化するかを検討している。
1)ウサギ胎児血管cDNAライブラリーを、PDGF-A鎖のコーディング部分をプローブとしてスクリーニングを行い、1.1kb(PA1)と2.3kb(PA3)の2種類のクローンを単離した。PA1は基本的にPDGF-A1と同一構造を持っていたが、PA3は、従来知られている、スプライシングの差によって生じるもう一つのアイソフォーム(PDGF-A2)とは異なる構造を持ち、その結果カルボキシル末端に38個の特異的アミノ酸配列を有することが判明した(以下PA3がコードする蛋白質をPDGF-A3とする)。
2)PDGF-A3が、ウサギにおいてPDGF-A2に代わるものか、あるいは新たな3番目のアイソフォームであるか否かを明らかにするために、スプライシング部分をはさんでPCRを施行した。その結果3種類のDNA断片が増幅され、それらは塩基配列からPDGF-A1、-A2および-A3と判断された。この結果より血管平滑筋は3種類のPDGF-A鎖アイソフォームを産生すること、またPDGF-A3は全く新しいPDGF-A鎖アイソフォームであることが明かとなった。
3)次いでPDGF-A3の蛋白レベルでの活性を検討した。PDGF-A1および-A3のcDNAを発現ベクターに組み込み、NIH3T3細胞にトランスフェクト後、その培養上清を部分精製し、ウェスタンブロットにてPDGF-A1および-A3は還元条件下で、それぞれ13kDおよび17kDの大きさのバンドとして検出した。さらにPDGF-A1および-A3の増殖活性を3H-チミジンの取込みにて検討したところ、PDGF-A1および-A3をトランスフェクトしたNIH3T3細胞の上清は強い増殖活性を示した。
この結果よりPDGF-A3は蛋白レベルで増殖活性を持つと結論された。
4)血管の各発生段階、および培養平滑筋細胞の増殖時におけるmRNAの発現をRNase protection assayにて検討した。PDGF-A1 mRNAは血管の発生が進むに伴い漸減した。PDGF-A3 mRNAの発現量は少量だが全ての発生段階で認められた。平滑筋細胞の増殖期には、PDGF-A1および-A3 mRNAは共に強く発現したが、コンフルエント状態では共に減少した。
5)アンギオテンシンIIの平滑筋細胞に対する増殖活性はPDGF-A鎖を介することが示された。そこでいずれのPDGF-A鎖アイソフォームのmRNAがアンギオテンシンII刺激で増加するのかを培養平滑筋細胞を用いて検討した。その結果10-9MのアンギオテンシンII刺激でPDGF-A3のmRNAが選択的に増加することが判明した。
<実験2>実験2の目的は、バルーニング後の平滑筋細胞増殖時の血管壁が産生するPDGF系とアンギオテンシン系のmRNAの発現を解析し、いずれがより重要な役割を演じているかを明らかにしている。
1)RNase protection assayに用いるtemplateの開発。
サンプル量が限られるために、高感度にmRNAを検出できるRNase protection assayを最初に開発した。RNAプローブの鋳型となるcDNAの多くは、PCR法でクローニングした。実験2では、ウサギのPDGF-A鎖、PDGF-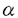 受容体、PDGF-
受容体、PDGF-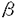 受容体、アンギオテンシノーゲン、ACE、アンギオテンシンII受容体(AT1A)、平滑筋ミオシン(胎児型及び成体型を識別可能)およびラットのアンギオテンシノーゲン、アンギオテンシンII受容体(AT1A)mRNAを本法により測定した。
受容体、アンギオテンシノーゲン、ACE、アンギオテンシンII受容体(AT1A)、平滑筋ミオシン(胎児型及び成体型を識別可能)およびラットのアンギオテンシノーゲン、アンギオテンシンII受容体(AT1A)mRNAを本法により測定した。
2)バルーニングが内膜肥厚の刺激として作用していることを確認する目的で、平滑筋細胞の胎児型への形質変換の有無を検討した。バルーニング血管においては成体型ミオシンmRNAの発現量が減少すると共に胎児型ミオシンmRNAが増加し、胎児型への形質変換が確認された。また組織学的にも著しい内膜肥厚が認められた。
3)バルーニング障害によってPDGF-A鎖、PDGF-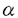 受容体およびPDGF-
受容体およびPDGF-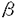 受容体mRNAの発現は著しく増加し、血管壁のPDGF系はup-regulateされた。
受容体mRNAの発現は著しく増加し、血管壁のPDGF系はup-regulateされた。
4)バルーニング障害によってウサギ頚動脈のACE、アンギオテンシンII受容体(AT1A)の発現は減弱し、血管壁のアンギオテンシン系はdown-regulateされた。アンギオテンシノーゲンmRNAは、ウサギ頚動脈ではその発現を検出できなかった。またラットの大動脈においてもアンギオテンシノーゲン、アンギオテンシンII受容体(AT1A)mRNAの発現はバルーニングによって減弱した。
以上、本研究において血管壁は3種類のPDGF-A鎖の遺伝子を発現すること、バルーニング障害後の血管壁再構築においては、血管壁のPDGF系の遺伝子発現がアンギオテンシン系よりもよりダイナミックに活性化されることが明らかにされた。本研究は現在臨床的に問題となっている動脈硬化性病変形成機序の解明に重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。