G蛋白質共役受容体は百種類以上存在することが知られており、細胞外から細胞内への情報伝達の入力点として機能している。これらの受容体の連続刺激により細胞応答が減弱もしくは消失してしまう、受容体の脱感受性という現象が知られている。 アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。 アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。 アドレナリン受容体についてはcAMP依存性キナーゼによる異種脱感受性および アドレナリン受容体についてはcAMP依存性キナーゼによる異種脱感受性および アドレナリン受容体キナーゼ( アドレナリン受容体キナーゼ( adrenergic receptor kinase,以下 adrenergic receptor kinase,以下 ARK)による同種脱感受性の2つの機構が働いていることが示されている。また、ロドプシンのロドプシンキナーゼによるリン酸化が光刺激受容の抑制因子として働いていることが示されている。G蛋白質共役受容体キナーゼは現在までに ARK)による同種脱感受性の2つの機構が働いていることが示されている。また、ロドプシンのロドプシンキナーゼによるリン酸化が光刺激受容の抑制因子として働いていることが示されている。G蛋白質共役受容体キナーゼは現在までに ARK、ロドプシンキナーゼを含めて6種類存在することが示されている。これらのキナーゼはG蛋白質共役受容体のセリンもしくはスレオニン残基をアゴニスト刺激依存性にリン酸化する。本研究においてはこのG蛋白質共役受容体キナーゼ特に ARK、ロドプシンキナーゼを含めて6種類存在することが示されている。これらのキナーゼはG蛋白質共役受容体のセリンもしくはスレオニン残基をアゴニスト刺激依存性にリン酸化する。本研究においてはこのG蛋白質共役受容体キナーゼ特に ARKの活性化機構を検討したものである。 ARKの活性化機構を検討したものである。 我々の研究室においてムスカリン性アセチルコリン受容体m2サブタイプ(以下m2受容体)をアゴニスト依存性にリン酸化する酵素(ムスカリン受容体キナーゼ)をブタ大脳より部分精製しており、この酵素によるm2受容体のリン酸化がG蛋白質  サブユニットにより活性化されることが見いだされていた。一方、 サブユニットにより活性化されることが見いだされていた。一方、 ARKによるリン酸化については ARKによるリン酸化については  サブユニットの効果は報告されていなかった。そこでこの サブユニットの効果は報告されていなかった。そこでこの  サブユニットによる効果がm2受容体、ムスカリン受容体キナーゼに特異的なものなのか否か、またその標的は受容体なのかキナーゼなのかを明らかにすることを試みた。 サブユニットによる効果がm2受容体、ムスカリン受容体キナーゼに特異的なものなのか否か、またその標的は受容体なのかキナーゼなのかを明らかにすることを試みた。 最初にこの酵素が他のG蛋白質共役受容体をリン酸化できるか検討した。ウシ肺より アドレナリン受容体を精製し、人工脂質膜に再構成しムスカリン受容体キナーゼと反応させた。 アドレナリン受容体を精製し、人工脂質膜に再構成しムスカリン受容体キナーゼと反応させた。 アドレナリン受容体はアゴニスト依存性にリン酸化され、そのリン酸化はG蛋白質 アドレナリン受容体はアゴニスト依存性にリン酸化され、そのリン酸化はG蛋白質  サブユニットにより促進された。次にこのG蛋白質 サブユニットにより促進された。次にこのG蛋白質  サブユニットの作用は受容体に結合し受容体をリン酸化されやすい状態に保つのか、あるいはムスカリン受容体キナーゼを活性化するのかを検討した。ウシ大脳より精製された サブユニットの作用は受容体に結合し受容体をリン酸化されやすい状態に保つのか、あるいはムスカリン受容体キナーゼを活性化するのかを検討した。ウシ大脳より精製された  サブユニットI及びII、ウシ錐体外節より精製されたGt サブユニットI及びII、ウシ錐体外節より精製されたGt  サブユニットを用い、基質としてm2受容体, サブユニットを用い、基質としてm2受容体, アドレナリン受容体、ロドプシンをそれぞれ用いた場合について比較検討した。これら3種類の基質について大脳の アドレナリン受容体、ロドプシンをそれぞれ用いた場合について比較検討した。これら3種類の基質について大脳の  サブユニットはGt サブユニットはGt  サブユニットに比して低濃度で活性化作用を示し、その濃度依存性はいずれの基質においても変化がなかった。またムスカリン受容体キナーゼはG蛋白質 サブユニットに比して低濃度で活性化作用を示し、その濃度依存性はいずれの基質においても変化がなかった。またムスカリン受容体キナーゼはG蛋白質  サブユニット存在下に熱処理に対する安定性が向上した。これらの結果は サブユニット存在下に熱処理に対する安定性が向上した。これらの結果は  サブユニットがムスカリン受容体キナーゼに結合し、キナーゼを活性化していることを示唆した。 サブユニットがムスカリン受容体キナーゼに結合し、キナーゼを活性化していることを示唆した。 次に ARK1をCOS7細胞に発現し ARK1をCOS7細胞に発現し ARKがムスカリン受容体をリン酸化するか、 ARKがムスカリン受容体をリン酸化するか、 ARKによるリン酸化がG蛋白質 ARKによるリン酸化がG蛋白質  サブユニットにより促進されるかを検討した。バキュロウイルス発現系を用いて産出、精製したm2受容体は サブユニットにより促進されるかを検討した。バキュロウイルス発現系を用いて産出、精製したm2受容体は ARK1によりアゴニスト依存性にリン酸化され、そのリン酸化はG蛋白質 ARK1によりアゴニスト依存性にリン酸化され、そのリン酸化はG蛋白質  サブユニットにより促進された。また、そのリン酸化は サブユニットにより促進された。また、そのリン酸化は ARK1の阻害剤であるヘパリンにより阻害された。このことからムスカリン受容体キナーゼと ARK1の阻害剤であるヘパリンにより阻害された。このことからムスカリン受容体キナーゼと ARK1は同一もしくは類縁のものであると考えられる。 ARK1は同一もしくは類縁のものであると考えられる。 ロドプシンキナーゼ、および ARK1の一次構造はリン酸化触媒部位で比較的相同性が高いが、ロドプシンキナーゼはG蛋白質 ARK1の一次構造はリン酸化触媒部位で比較的相同性が高いが、ロドプシンキナーゼはG蛋白質  サブユニットにより活性化されないことが報告されていた。 サブユニットにより活性化されないことが報告されていた。 ARK1の方がカルボキシル基末端側で128残基分長い。この部分に ARK1の方がカルボキシル基末端側で128残基分長い。この部分に  結合部位があるのではないかと推測しこの部分の一部を欠損した変異体を作成した。この 結合部位があるのではないかと推測しこの部分の一部を欠損した変異体を作成した。この ARK変異体はm2受容体をアゴニスト依存性に、ロドプシンを光依存性にリン酸化したが ARK変異体はm2受容体をアゴニスト依存性に、ロドプシンを光依存性にリン酸化したが  サブユニットによる活性化はみられなかった。このことから サブユニットによる活性化はみられなかった。このことから  サブユニットは直接 サブユニットは直接 ARK1に結合し、その結合部位は ARK1に結合し、その結合部位は ARK1のカルボキシル基末端付近にあると結論した。 ARK1のカルボキシル基末端付近にあると結論した。  ARKによる受容体のリン酸化は、アゴニストまたは光により活性化されたG蛋白質共役受容体のみを基質にするという点においては特異性が高いがリン酸化部位のアミノ酸残基配列は特異的ではない。また ARKによる受容体のリン酸化は、アゴニストまたは光により活性化されたG蛋白質共役受容体のみを基質にするという点においては特異性が高いがリン酸化部位のアミノ酸残基配列は特異的ではない。また アドレナリン受容体やロドプシンではカルボキシル基末端付近のセリン、スレオニン残基がリン酸化されるのに対して、m2受容体では細胞内第3ループのセリン、スレオニン残基がリン酸化され、受容体によりリン酸化される部位も異なっている。またリン酸化部位のペプチドを アドレナリン受容体やロドプシンではカルボキシル基末端付近のセリン、スレオニン残基がリン酸化されるのに対して、m2受容体では細胞内第3ループのセリン、スレオニン残基がリン酸化され、受容体によりリン酸化される部位も異なっている。またリン酸化部位のペプチドを ARKによりリン酸化する際のVmax/Km値は受容体を基質にした場合と比べて1000-10000倍低い。これらの事実はアゴニスト結合受容体が ARKによりリン酸化する際のVmax/Km値は受容体を基質にした場合と比べて1000-10000倍低い。これらの事実はアゴニスト結合受容体が ARKを活性化するという仮説で説明可能である。この仮説を検証するため、m2受容体の ARKを活性化するという仮説で説明可能である。この仮説を検証するため、m2受容体の ARKによるリン酸化部位を含む細胞内第3ループの大部分をを欠損させた受容体(以下m2LD受容体)をバキュロウイルス発現系を用いて産出、精製した。この受容体はムスカリン性リガンドに対する親和性は野生型m2受容体と変化がなかったが、 ARKによるリン酸化部位を含む細胞内第3ループの大部分をを欠損させた受容体(以下m2LD受容体)をバキュロウイルス発現系を用いて産出、精製した。この受容体はムスカリン性リガンドに対する親和性は野生型m2受容体と変化がなかったが、 ARK1によるリン酸化を受けなかった。グルタチオン転移酵素とm2受容体第3細胞内ループとの融合蛋白質の ARK1によるリン酸化を受けなかった。グルタチオン転移酵素とm2受容体第3細胞内ループとの融合蛋白質の ARK1によるリン酸化はm2LD受容体とアゴニストの共存下で促進された。この結果はアゴニスト結合受容体が ARK1によるリン酸化はm2LD受容体とアゴニストの共存下で促進された。この結果はアゴニスト結合受容体が ARK1の活性化能を持つことを示唆している。 ARK1の活性化能を持つことを示唆している。 m2LD受容体とG蛋白質GoもしくはGi2との脂質膜への再構成標品でGTP S結合のアゴニストによる促進と、GTP感受性の高親和性アゴニスト結合が野生型m2受容体と同様に観察された。これはm2LD受容体が野生型m2受容体と同様にG蛋白質と相互作用できることを意味しており、欠損した第3細胞内ループ部分はG蛋白質との相互作用は必要ないことを示めしている。さらに、 S結合のアゴニストによる促進と、GTP感受性の高親和性アゴニスト結合が野生型m2受容体と同様に観察された。これはm2LD受容体が野生型m2受容体と同様にG蛋白質と相互作用できることを意味しており、欠損した第3細胞内ループ部分はG蛋白質との相互作用は必要ないことを示めしている。さらに、 ARK1によるリン酸化を受けたm2受容体もリン酸化されていない受容体と同様のG蛋白質との相互作用を示した。以上の結果は受容体のリン酸化のみによりG蛋白質との相互作用が阻害されるという仮説を否定する。 ARK1によるリン酸化を受けたm2受容体もリン酸化されていない受容体と同様のG蛋白質との相互作用を示した。以上の結果は受容体のリン酸化のみによりG蛋白質との相互作用が阻害されるという仮説を否定する。 アゴニストの受容体への結合により、G蛋白質が活性化されて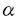 サブユニットと サブユニットと  サブユニットに分離しそれぞれの効果器となる酵素やイオンチャネルなどにシグナルを伝達すると同時に受容体自身は サブユニットに分離しそれぞれの効果器となる酵素やイオンチャネルなどにシグナルを伝達すると同時に受容体自身は ARKによりリン酸化されると考えられる。 ARKによりリン酸化されると考えられる。 ARKはアゴニスト結合受容体と ARKはアゴニスト結合受容体と  サブユニット双方により相乗的に活性化されて受容体をリン酸化すると考えられる。しかしながら、受容体のリン酸化のみにより受容体とG蛋白質との相互作用は阻害を受けない。受容体のリン酸化と受容体の脱感受性機構の研究が今後の検討課題である。 サブユニット双方により相乗的に活性化されて受容体をリン酸化すると考えられる。しかしながら、受容体のリン酸化のみにより受容体とG蛋白質との相互作用は阻害を受けない。受容体のリン酸化と受容体の脱感受性機構の研究が今後の検討課題である。 |  アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。
アドレナリン受容体及び視細胞の光受容体であるロドプシンについて多くの研究がなされている。 サブユニットにより活性化されることが見いだされていた。一方、
サブユニットにより活性化されることが見いだされていた。一方、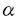 サブユニットと
サブユニットと