我々は、ブタ脳、脊髄中の未知の神経ペプチドを検索する過程で、ヒヨコ直腸弛緩活性を有する新規のペプチドを発見した。このペプチドは、構造上、心房性ナトリウム利尿ペプチド(atrial natriuretic peptide,A-type natriuretic peptide,ANP)、脳性ナトリウム利尿ペプチド(brain natriuretic peptide,B-type natriuretic peptide,BNP)と高い相同性があり、実際、ナトリウム利尿作用、降圧作用を示すことから、我々はこれを第3のナトリウム利尿ペプチド(C-type natriuretic peptide,CNP)と命名した。 ブタ脳内より単離されたCNPには、22個のアミノ酸からなるCNP-22およびCNP-22のN末にさらに31個のアミノ酸がついた53個のアミノ酸からなるCNP-53の2種類が存在し(図1)、新鮮組織中ではCNP-22に比べCNP-53がかなり多く存在していることから、ブタ脳内において機能している活性本体はCNP-53である可能性が高い。 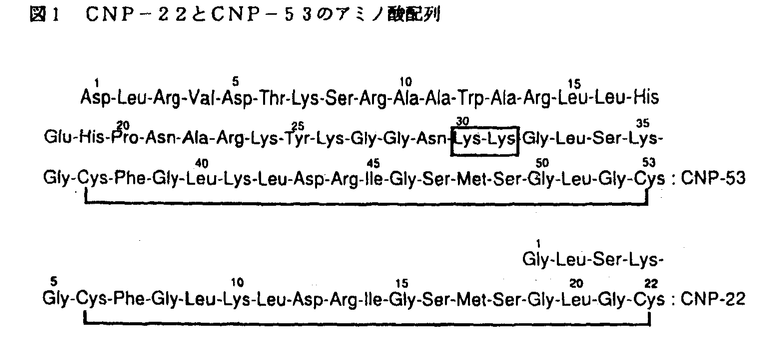 図1 CNP-22とCNP-53のアミノ酸配列 図1 CNP-22とCNP-53のアミノ酸配列 ANP、BNPに関しては、すでにそのcDNAが単離されており、構造解析の結果からその生合成経路が明らかにされている。また、精製標品のアミノ酸配列およびcDNAの塩基配列の解析結果から、ANPについてはヒト、ラット、イヌ、ウサギの構造が明らかにされており、BNPについてはヒト、ブタ、ラットの構造が明らかとなっている。ANPの構造がこれらの種でよく保存されているのに対し、BNPのそれには種差があることが知れている。さらに、ANPについては構造活性相関についても、検討がなされている。一方、CNPについては、これらの点が明らかとなっていなかった。そこで我々は、ブタおよびヒトのCNP遺伝子を単離し、その塩基配列を解析することによって、ヒトCNPの構造を明らかにするとともにCNPの生合成経路を明らかにした。さらに、CNPのアミノ酸配列を一部ANPのそれに置換したCNP誘導体を数種合成し、それらの活性を確認することにより、活性発現に重要なアミノ酸配列を同定したので報告する。 我々はまず、CNP-53のアミノ酸配列を基に合成したオリゴヌクレオチドプローブを用いてブタ肝臓由来のDNAより調製された遺伝子ライブラリーをスクリーニングすることにより、ブタCNP遺伝子を単離しその構造を解析した。その結果、CNPは他のペプチドホルモン同様前駆体として合成され、プロセシングを受けて生成することが明らかとなった。詳しく述べるならば、ブタCNP前駆体は126個のアミノ酸で構成され、N末端に23個のアミノ酸からなるシグナルペプチドを持つ分泌蛋白であり、CNP-22およびCNP-53は前駆体のC末端に位置し、シグナルペプチドが除かれた103個のアミノ酸からなるpro-CNPから塩基性アミノ酸を認識するプロセシング酵素によって生成される。また、他のナトリウム利尿ぺプチドと比較した場合のCNPの構造上の特徴であるC-terminal tailの欠落は、CNPのC末端のアミノ酸であるシステインをコードするコドンの直後にストップコドンが存在することから、翻訳後の修飾等によるものではなくCNPが本来持つ構造であることが確認された。これらの点は、ブタCNP遺伝子をCOS細胞を用いて一過性に発現させることによって得られたmRNAおよび遺伝子産物を解析することによっても確認された。ブタCNP遺伝子をプローブとして用いたsouthern hybridizationの解析結果から、ヒトにもCNPをコードする遺伝子が存在することが明らかとなったので、我々は、ヒト肝臓由来のDNAより調製された遺伝子ライブラリーをスクリーニングすることにより、ヒトCNP遺伝子を単離し、その構造を解析した。その結果、ヒトCNP遺伝子は、CNP前駆体をコードしているエクソン部分のみならず、プロモーター領域およびイントロンにおいても、塩基数および塩基配列の点で、ブタCNP遺伝子と高い類似性を持つことが明らかとなった。また塩基配列から推定されるアミノ酸配列を解析した結果、ヒトにおいてもブタ同様126個の前駆体からプロセシングを受けてCNP-22およびCNP-53が合成されうることが明らかになるとともに、CNP-22のアミノ酸配列がヒトとブタで全く同一であること、CNP-53においても、その相違がわずか2個であることが確認された(図2)。ヒトCNP-53については新規のペプチドであることから、これを化学合成し、その生理活性を検討した。その結果このペプチドにも、ブタCNP-53同様のナトリウム利尿作用、降圧作用が認められ、これが生体内において生理活性ペプチドとして機能する可能性が示された。 図3に、今回の遺伝子の解析結果から明らかとなった、CNPの生合成経路のまとめを示す。  図表図2 CNP前駆体のアミノ酸配列の比較 / 図3 CNPの生合成経路 図表図2 CNP前駆体のアミノ酸配列の比較 / 図3 CNPの生合成経路 すでにその構造および機能が詳細に検討されている他のナトリウム利尿ペプチド、ANP,BNPとCNPの生物活性は、以下の点で大きく異なる。すなわち、CNPは麻酔下でラットに静注すると利尿作用、降圧作用を示すが、その強度はANPに比べそれぞれ約1/100,1/30に過ぎない。ANPとBNPがほぼ同程度の作用を有することを考えると、CNPの循環ホルモンとしての作用はナトリウム利尿ペプチドの中でも極めて弱いといえる。このことはナトリウム利尿ペプチドのセカンドメッセンジャーと考えられているcGMPの産生量を腎糸球体および摘出血管を用いて、ANPとCNPで比較した結果からも支持される。一方、培養血管平滑筋細胞においては、CNPはANPの約4倍、cGMPの産生を促進する。また、DNA合成の阻害を指標にして両者を比較した場合も同様の結果が得られている。 ここで問題となるのは、なぜCNPとANP,BNPの作用の強さが組織系と培養系で逆転するのかという点である。ナトリウム利尿ペプチドにはグアニレートシクラーゼとカップルし、セカンドメッセンジャーであるcGMPの産生につながる2種類のレセプター(NPR-A,NPR-B)とクリアランスに関与するレセプター(NPR-C)の合計3種類のレセプターの存在が知られている。’91にKollerらはANPおよびBNPがNPR-Aに選択的なリガンドである一方CNPがNPR-Bに選択であることを明らかにした。したがって、intactな血管では主にNRP-Aが発現しているが、これをin vitroの培養系に移すと、レセプターのクラススイッチが起こり主にNPR-Bが発現するようになると考えられる。 そこで我々は、種々のCNP誘導体を合成し、ラット培養平滑筋細胞を用いてNPR-Bに対するCNPの構造活性相関をcGMPの産生を指標にANPとの比較から検討した(表1)。その結果、CNPは分子内に1ヶ所ジスルフィド結合を持っているが、この2つのシステイン残基に挟まれた17個のアミノ酸からなるCNP(6-22)が活性の最小単位であること、特にこの中の9番目から11番目の3つのアミノ酸Leu-Lys-LeuがNPR-Bを介しての活性の発現に重要であることが明らかとなった。  表1 CNP誘導体のcGMP産生促進活性 表1 CNP誘導体のcGMP産生促進活性 また、合成した誘導体のDNA合成阻害活性を測定した結果、この活性とcGMP産生促進活性とが非常に良く相関することが示された。さらに、これらの結果を確認する目的で、主なCNP誘導体のcGMP促進活性をNPR-AおよびNPR-B cDNAを導入し、発現させたCHO細胞を用いて検討した結果、 -ANPの10番目から12番目のアミノ酸配列を上記CNPの配列Leu-Lys-Leuで置換した誘導体17([Leu-Lys-Leu]ANP)は、NPR-AおよびNPR-Bの両レセプターに反応することが示された。 -ANPの10番目から12番目のアミノ酸配列を上記CNPの配列Leu-Lys-Leuで置換した誘導体17([Leu-Lys-Leu]ANP)は、NPR-AおよびNPR-Bの両レセプターに反応することが示された。 以上、我々は、第3のナトリウム利尿ペプチドCNPの遺伝子を単離し、その構造を解析することにより、ヒトCNPの構造を初めて明らかにするとともに、本ペプチドの生合成経路をも明らかにした。また、本ペプチドの種々の誘導体を合成し、その構造活性相関を解析することにより、CNP-22のN-末端9番目から11番目の3つのアミノ酸Leu-Lys-LeuがNPR-Bを介しての活性発現に重要であることを明らかにし、さらにNPR-AおよびNPR-Bの両レセプターに結合し最大反応を引き出す初めての誘導体([Leu-Lys-Leu]ANP)を見いだした。これらの成果は、本ペプチドの生理作用、そのメカニズムを解明する上で有用であるとともに、より血管平滑筋の増殖抑制活性の強いペプチドあるいは非ペプチド型のアゴニストを合成し、血管の狭窄あるいは動脈硬化の進展を防止する医薬品を開発する上でも極めて有用である。 |