細胞外マトリックスは、細胞の分化・増殖・移動などに関与するが、多様な構成成分と強固な線維構造のために、形成機構には不明な点が多い。 細胞外マトリックスの主要な構成成分であるフィブロネクチンは、細胞を介する独自のマトリックス形成能(マトリックスアセンブリー能)をもつ糖タンパク質であり、コラーゲンやプロテオグリカンなど他の細胞外マトリックス成分との結合活性を有することから、細胞外マトリックスの形成に中核的な役割を果たすと考えられる。フィブロネクチンは、結合特異性の異なる6個の機能ドメインからなり、各ドメインはアミノ酸配列の類似性からそれぞれI型、II型、III型モジュールとよばれる3種の繰り返し構造からなる(図1.A)。 本研究では、フィブロネクチンのマトリックスアセンブリーに必要なドメインを同定することを目的とした。そのために、遺伝子工学的手法を用いて、特定のドメインのみから成るヒト組換えフィブロネクチンをマウス線維芽細胞であるL細胞で発現させ、L細胞の細胞外マトリックスヘの取り込みを調べた。 -アクチンプロモーターとSV40のポリA付加配列を含むプラスミドに、プロテインCインヒビターの分泌シグナルとフィブロネクチンの特定のドメインをコードするcDNAを連結して発現ベクターを作製した。リン酸カルシウム法を用いて、フィブロネクチン発現ベクターとネオマイシン耐性遺伝子を含むプラスミドとを、同時にマウスL細胞に導入した。G418を含む培養液を用いて導入遺伝子を発現する細胞を選択し、ノーザンブロット法やメタボリックラベリング、あるいは培養上清に分泌された組換えフィブロネクチンのイムノプロット解析を行い、各組換えフィブロネクチンについて最も発現の高い細胞株を樹立した。 -アクチンプロモーターとSV40のポリA付加配列を含むプラスミドに、プロテインCインヒビターの分泌シグナルとフィブロネクチンの特定のドメインをコードするcDNAを連結して発現ベクターを作製した。リン酸カルシウム法を用いて、フィブロネクチン発現ベクターとネオマイシン耐性遺伝子を含むプラスミドとを、同時にマウスL細胞に導入した。G418を含む培養液を用いて導入遺伝子を発現する細胞を選択し、ノーザンブロット法やメタボリックラベリング、あるいは培養上清に分泌された組換えフィブロネクチンのイムノプロット解析を行い、各組換えフィブロネクチンについて最も発現の高い細胞株を樹立した。 最初に、フィブロネクチンのC末端フィブリン結合(Fib2)ドメインのみを含む37kDa領域を単独で発現させた(図1.B上段、rF2)。rF2は、インタクトなフィブロネクチンと同様に、2量体形成能を保持し、それ自身のホモダイマーおよびマウスフィブロネクチンとのヘテロダイマーとして分泌された。また、rF2発現細胞では、細胞外マトリックスがヒトフィブロネクチンのFib2ドメインに特異的なモノクローン抗体FN8-12で染色されたことから、rF2がマトリックスに取り込まれることがわかった。rF2は、還元条件のSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)では、分子量6万から9万の位置に広がる不均一なバンドとなった。この原因を調べるために、抗体カラムを用いて培養液中に分泌されたrF2を精製した。rF2は、N-結合型糖鎖の認識配列を含んでいるにもかかわらず、ペプチド:N-グリコシダーゼFで処理しても移動度は変化せず、レクチンブロット解析でも、N-結合型糖鎖が存在している証拠は見いだせなかった。rF2を、ノイラミニダーゼとO-結合型糖鎖を特異的に切断するN-アセチルガラクトサミニダーゼで処理し、SDS-PAGEを行うと、ほぼcDNAから予想される分子量の位置に均一なバンドとして検出された。ノイラミニダーゼ処理したrF2がピーナッツレクチンと反応すること、トリプシンで限定分解したrF2ではこの反応性が消失することから、rF2には、血漿フィブロネクチンで見いだされたのと同様、IIICS領域にシアル酸の結合したO-結合型糖鎖が存在することが明らかとなった。分泌されたrF2とは異なり、細胞質のrF2では不均一性が認められなかったことから、フィブロネクチンの分泌にはO-結合型糖鎖の付加が重要な役割を果たすことが示唆された。 つぎに、マトリックスアセンブリーに関与すると報告されているN末端70kDa領域を、単独の組換えタンパク質r70として発現させた(図1.C)。r70は、C末端の2量体形成部位を含まないために単量体として合成分泌され、予想どおりの分子量を示したが、細胞外マトリックスには取り込まれなかった。一方、N末端70kDa領域をC末端37kDa領域に連結した組換えタンパク質r70F2(図1.D上段)では、2量体形成能は保持され、それ自身のホモダイマーとマウスフィブロネクチンとのヘテロダイマーとして分泌された。35Sメチオニンを用いたパルスチェイス実験から、r70はほとんど細胞表面にとどまらないが、r70F2は相当量が細胞表面にとどまることが示された。r70F2発現細胞の細胞外マトリックスを、ヒトフィブロネクチンに特異的なモノクローン抗体FN9-1およびFN8-12(図1.A)を用いて蛍光抗体法を行うと、それぞれの抗体で網目状の構造として強く染色された。細胞接着ドメインをもたないr70F2がマトリックスに取り込まれたことから、フィブロネクチンのマトリックスアセンブリーには、 5 5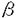 1インテグリンは必ずしも必要ではないと考えられた。FN8-12の染色性は、rF2の場合よりr70F2の方が強かったことから、N末端70kDa領域は単独ではアセンブリーの活性がないものの、C末端37kDa領域と協同することがマトリックスへの取り込みに重要であることが示唆された。 1インテグリンは必ずしも必要ではないと考えられた。FN8-12の染色性は、rF2の場合よりr70F2の方が強かったことから、N末端70kDa領域は単独ではアセンブリーの活性がないものの、C末端37kDa領域と協同することがマトリックスへの取り込みに重要であることが示唆された。 このようなC末端37kDa領域の役割が、すでに報告されているような単なる2量体の形成だけなのか、独自のマトリックスアセンブリーの活性をもつのか、という点について検討した。そのために、C末端37kDa領域の機能単位であるFib2ドメインと2量体形成部位について、変異を導入した組換えタンパク質を発現させ、細胞外マトリックスへの取り込みを比較した。2量体形成部位に関しては、2個のシステイン残基がともにセリン残基となるように改変し、2量体を形成しないrF2とr70F2、すなわち、rF2monoとr70F2monoを発現させた(図1.B下段とD下段)。これらの組換えタンパク質は、予想どおり単量体として産生され、rF2monoは、マトリックスに取り込まれなかった。一方、r70F2monoは、r70F2より弱いながら、マトリックスに取り込まれたことから、2量体の構造は、フィブロネクチンの細胞外マトリックスへの取り込みを増加させるが、取り込みには必ずしも必要ではないことが明らかとなった。 Fib2ドメインが直接アセンブリーに関与するかどうかを確かめるために、フィブロネクチン断片を用いたアセンブリー阻害実験を行った。ヒト血漿フィブロネクチン由来のN末端70kDa断片とC末端37kDa断片を、それぞれr70F2発現細胞の培養液に添加したところ、N末端70kDa断片より弱いものの、C末端37kDa断片は濃度依存的にr70F2の細胞外マトリックスへのアセンブリーを阻害した。この結果から、Fib2ドメインは独自のアセンブリー活性を持つものと考えられた。 このアセンブリー活性の中心となる領域を同定するために、r70F2について、Fib2ドメインを構成するIII15モジュールと3個のI型モジュール(I10,I11,I12)をすべて欠失したr70DS、およびI型モジュールのみ欠失したr70F2(dI10-12)を発現させた(図1.E)。両者とも、r70F2と比較して、マトリックスへの取り込みが著しく減少していたことから、Fib2ドメインの活性部位が3個のI型モジュールにあると考えられた。また、どちらもそれ自身のホモダイマーは形成されなかった。したがって、Fib2ドメインの3個のI型モジュールは、生合成過程における2量体形成のための分子認識にも関与することが示唆された。 Fib2ドメインのアセンブリー活性に、どのI型モジュールが必要かを調べるために、3個のI型モジュールのうち1個だけを欠失させた変異r70F2、すなわちr70F2(dI10)、r70F2(dI11)およびr70F2(dI12)を発現させた(図1.E)。これらの変異を導入したr70F2では、いずれも、コントロールのr70F2よりマトリックスへの取り込みが減少したが、それぞれの間で著しい違いが見られなかったことから、マトリックスアセンブリーにおけるFib2ドメインの活性は、特定のアミノ酸配列ではなく、3個のI型モジュールの集合体が重要であると考えられた。さらに、rF2発現細胞の細胞外マトリックス中には、ヘテロダイマーの他に、rF2のホモダイマーが取り込まれたことがら、Fib2ドメインを介したマトリックスアセンブリーがあることが明らかとなった。  図1.フィブロネクチンのモジュラー構造とマトリックスアセンブリー能 図1.フィブロネクチンのモジュラー構造とマトリックスアセンブリー能 今後は、フィブロネクチンのマトリックスアセンブリーにおけるFib2ドメインと他の機能ドメインとの相互作用について調べることが必要である。マトリックスアセンブリーの活性には、N末端70kDa領域とC末端37kDa領域の連結、および2量体の形成が重要であると考えられることから、r70F2にフィブロネクチンと同様の線維形成能があるかどうかも興味深い今後の課題である。 A.フィブロネクチンの構造、B.C末端37kDa領域単独の組換えフィブロネクチン、C.N末端70kDa領域単独の組換えフィブロネクチン、D.N末端70kDa領域とC末端37kDa領域の融合組換えフィブロネクチン、E.r70F2におけるFib2ドメインの欠失組み換え体 |