K.Ishizaka等は、IgE抗体産生調節機構の研究において、ネズミのCD4陽性T細胞がIgE結合因子を産生する事、また、このIgE結合因子には、二種の相反する生物活性を示すIgE増強因子とIgE抑制因子が存在する事を見出した。このIgE増強因子とIgE抑制因子は同一のポリペプチドを有しているが、近年、その糖鎖構造が異なっている事が明らかとなった。IgE増強因子は高マンノース-N-グリコシド型、およびO-グリコシド型糖鎖を持つのに対し、IgE抑制因子は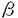 -グリコシド結合ガラクトースを含むO-グリコシド型糖鎖を持ち、N-グリコシド型糖鎖は持たない。その後、このIgE結合因子の糖鎖修飾を調節する因子として、N-グリコシド型糖鎖合成を増強しIgE増強因子を産生させるグリコシル化促進因子(GEF)と、N-グリコシル型糖鎖合成を抑制しIgE抑制因子を産生させるグリコシル化抑制因子(GIF)の存在が示された。GIFは、in vitroでは、T細胞ハイプリドーマの産生するIgE増強因子をIgE抑制因子へと変換する作用を示す。一方、部分精製されたGIFをin vivoに投与すると、IgEのみならずIgG産生をも抑制する事が示された。また、GIFには、抗原に対して親和性を示し、その抗原に対する抗体産生を特異的に抑制する抗原特異的GIFというものが存在する事も明らかとなった。この様な結果より、GIFはサプレッサーT細胞が産生するサプレッサー因子の一つではないかと考えられてきた。 -グリコシド結合ガラクトースを含むO-グリコシド型糖鎖を持ち、N-グリコシド型糖鎖は持たない。その後、このIgE結合因子の糖鎖修飾を調節する因子として、N-グリコシド型糖鎖合成を増強しIgE増強因子を産生させるグリコシル化促進因子(GEF)と、N-グリコシル型糖鎖合成を抑制しIgE抑制因子を産生させるグリコシル化抑制因子(GIF)の存在が示された。GIFは、in vitroでは、T細胞ハイプリドーマの産生するIgE増強因子をIgE抑制因子へと変換する作用を示す。一方、部分精製されたGIFをin vivoに投与すると、IgEのみならずIgG産生をも抑制する事が示された。また、GIFには、抗原に対して親和性を示し、その抗原に対する抗体産生を特異的に抑制する抗原特異的GIFというものが存在する事も明らかとなった。この様な結果より、GIFはサプレッサーT細胞が産生するサプレッサー因子の一つではないかと考えられてきた。 サプレッサーT細胞の関与する免疫応答の制御機構については、サプレッサー因子の物質的同定が今日までなされてこなかったため、十分解明されたとは言い難い。そこで本研究では、GIFの分子的実体を明らかにする事を目的として、その遺伝子をクローニングし、また大腸菌や動物細胞を用いた組み換え体GIFを作成し、GIFの構造と機能についての解析を行った。 まずマウスGIF産生T細胞ハイプリドーマの無血清培養上清より、GIF候補タンパクを精製し、そのアミノ酸配列の一部を決定した。その配列を元にマウスGIF cDNAをクローニングした。さらに、そのcDNAをプローブとしてヒトGIF cDNAをクローニングした。cDNAより予想されるヒトおよびマウスGIFの全アミノ酸配列は下図のとおりである。  図表(上段はヒトのGIF配列、下段はマウスGIFの配列でヒトと異なるアミノ酸についてのみ記載) 図表(上段はヒトのGIF配列、下段はマウスGIFの配列でヒトと異なるアミノ酸についてのみ記載) ヒトとマウスGIFは約90%のホモロジーを有し、ヒトGIFがマウスの細胞にも作用するというこれまでのデータを支持した。しかし、1)GIFは分泌タンパクであるにもかかわらずこのタンパクはシグナル配列を有していない事、2)ノザンプロットの結果これまでGIF活性が見られなかった細胞でもmRNA産生が見られる事、さらに3)ヒトGIFの配列は、J.David等より報告されていたヒトMIF(Macrophage Migration Inhibitory Factor)と1アミノ酸を除いて同一である事、の三つの問題が見出された。そこで、本cDNAがGIFをコードするものである事を証明するために、1)本cDNAを用いて作成した組み換え体に対する抗体がハイブリドーマ由来GIFと特異的に反応する事、2)組み換え体がGIF活性を示す事、さらには、3)MIF活性はない事、等についての評価を行った。 マウスGIF cDNAを大腸菌を用いて発現させ、精製タンパクをウサギに免疫して抗体を作成した。この抗体を結合させたアフィニティーカラムを作成し、マウスGIF産生ハイブリドーマおよび、本研究の過程で新たに作成したスギ花粉抗原に対して特異性を示すGIFを産生するヒトT細胞ハイブリドーマのそれぞれの培養上清をこのカラムで分画したところ、GIF活性を示す13kDaタンパクはすべて特異的に吸着する事が判明した。次に、大腸菌およびCOS-1細胞で発現させたヒトGIFについてその活性を評価した結果、組み換えGIFは、in vitroにおいてIgE増強因子をIgE抑制因子に変換するGIF活性を示し、さらに、抗原感作したマウスに組み換えGIFを投与した所、抗体産生を用量依存的に抑制する事も証明された。 以上の結果より、クローニングされたcDNAが、GIFをコードするものである事が断定できた。次に、GIFとMIFの活性の違いが1アミノ酸の相違によるのか否か全評価するため、組み換えGIFおよび組み換えMIFについてその活性を検討した結果、いずれもGIF活性は示すもののMIF活性は示さない事が明らかとなった。その後、MIF活性はこの遺伝子産物由来ではなかった事がJ.Davidより報告されこの問題は決着した。 一連の活性評価の過程で、組み換えGIFは生物活性を示すものの、比活性がハイブリドーマ由来GIFに比べて低い事が判明した。一般に分泌タンパクはその分泌過程において活性に必要な修飾やフォールディングを受けるが、GIFはシグナル配列を欠いているため例えばCOS-1細胞で発現した組み換えGIFは必要な修飾を受けていないという事が考えられた。そこで、ERからゴルジ体を介した経路によりGIFを分泌させるべく、ヒトカルシトニン前駆体のプロ領域をコードするcDNAとGIF cDNAを融合し、さらにその融合タンパクを融合部位で切断するための特異的プロテアーゼであるフリンcDNAを同時にCOS-1細胞にトランスフェクトした。その結果分泌した成熟体のGIFは、ハイブリドーマ由来GIFとほぼ同等の比活性を示した。各種GIFの比活性を下表に示す。  図表(231F1、31E9はGIF産生ハイブリドーマ、cGIFは融合タンパクとして発現させたGIF。詳細は本文参照) 図表(231F1、31E9はGIF産生ハイブリドーマ、cGIFは融合タンパクとして発現させたGIF。詳細は本文参照) さらに、活性の全く見られないGIFタンパクを発現している細胞の存在も示された。これらの結果より、GIFはその分泌過程においてposttranslationalな修飾を受け、それが活性の発現に重要な役割を果たしているという事が示唆された。 そこで、次にGIFの構造的特徴について解析全試みた。MASSスペクトル、逆相カラム等を用いた解析よりCIFは分子内S-S架橋はもたないものの、一カ所のCys残基は非常に酸化されやすい事、また、比活性の低い大腸菌由来組み換えGIFには何等の修飾も見られないのに対して、比活性の高いGIFでは、疎水性のより高いGIF分子が存在する事や分子量が若干増加したGIF分子が存在する事等が明らかとなってきた。 本研究では、サプレッサー因子の一つと考えられるGIFのタンパク構造を初めて明らかにするとともに、その構造に基いて作成した組み換えGIFがin vitroおよびin vivoでも活性を示す事を証明した。さらに、GIFタンパクはその分泌過程において何らかの修飾を受け、それが生物活性に関与する事も示した。またその調節は、細胞のサブセットにより異なる事も明らかとなった。サプレッサーT細胞の一つの性状が、サプレッサー因子の単なる産生という事だけではなく、特別な修飾機能の有無の観点からも定義され得るという根拠を示したものと考えている。 |