研究の背景と目的 内皮細胞は、血管の内張り、すなわち内膜を構成する扁平な細胞である。内皮細胞にはactin filament(以下AF)を中心とした細胞骨格系が備わっている。これまでの研究から、内皮細胞のAFの束には、細胞の外縁に沿って局在するperipheral band(以下PB)と細胞質内を血流方向に走行するstress fiber(以下SF)との2種類があり、大動脈などの太い動脈の内皮細胞はPBのみを、細い動脈の内皮細胞はSFを持つことが知られている。また、培養内皮細胞を用いた研究により、血管内皮にかかるズリ応力(血流が内皮細胞を下流に押し流そうとする力)がSFの形成に深くかかわっていることが示唆されている。
しかしこれまで、in vivoの内皮細胞におけるAFの局在パターンが恒常的なものなのか、それとも発達過程で経時的に変化するのか、についてはデータがなかった。また、大動脈から細動脈に至るまでの経路のどこでAFの局在パターンが変化するのか、その変化は急激に起こるのか、それとも中間的なパターンを経てなだらかに起こるのか、についても、系統的な研究がなかった。さらに、in vivoの動脈系内皮細胞におけるAFの機能について、積極的に論じられることはなかった。
本研究では、in vivoの内皮細胞におけるAFパターンの局在について、その一般則を明らかにしようと試みた。検討する系としては、ラットの大動脈と腎臓内動脈系とを選び、前者において生後発達の過程における変化を、また、後者において組織内動脈系の各部位における違いを、それぞれ明らかにした。さらに、内皮細胞におけるAFの局在パターンと、血管にかかる力学的刺激との関係を考察し、in vivoの動脈系内皮細胞におけるAFの機能について論じた。
本研究では、内皮細胞という単一の細胞種を、あえて「形態学的に不均一な集団」ととらえている。単一細胞種の間での形態的多様性に注目して比較検討することにより、一般的な法則性を導こうとしている点が、本研究の特徴である。
1.大動脈内皮細胞におけるAFの局在の経時的変化 生後発達の観察のため、出生直後から60日令までのラットを用いた。灌流固定した大動脈の全長を摘出し、detergent処理した後、AFを特異的に染色するrhodamine-phalloidinで染色した。観察は、光学的断層像の得られる共焦点レーザー走査顕微鏡を用いて行なった。また灌流固定した胸部大動脈の標本を低温脱水法で処理し、透過型電子顕微鏡で観察した。さらに光顕・電顕写真上で形態計測を行ない、発達過程を追って統計学的な比較を行なった。
出生直後の大動脈内皮細胞では、成体の場合と異なり、大動脈の全域で主に長いSFが局在していた(SF-pattern)。10日令では、SFとPBが共在しており(PB-SF-pattern)、20日令以降では、PBが主体でSFが散在する(PB-pattern)成体のパターンになっていた。AFの局在がPB-patternを示す様になると、大動脈の部位による局在の違いが認められるようになり、動脈の分岐の周辺では、短いSFが発達していた。また、AFの局在パターンの変化と平行して、内皮細胞間の接着面の超微細構造が、平坦な面から複雑にかみあった形へと次第に変化した。形態計測の結果、個々のSFの長さやSFの線密度(単位面積当たりの総延長)は、20日今以降の内皮に比べて、0日から10日令の内皮の方が有意に長いことが示された。また、生後発達の過程で、電顕切片像上での内皮細胞間の接触部分が長くなるのに対して、内皮細胞の厚さは減少し、接着面の形状が次第に複雑になってゆく過程が定量的にも示された。細胞周辺部のAFは、主に細胞間接着装置の周辺や細胞質の突起の中に局在していた。
ラットの生後発達の過程で、大動脈の内圧・内径は急激に増大する。その結果、ラプラスの法則で計算される壁の張力は、生後の二ヵ月間で約7倍に達する。大動脈内皮細胞では、細胞の周囲にPBを配置し、そのAFの力学的なサポートによって隣り合う細胞間の細胞質のかみあいinterdigitationを形成することによって、細胞間の接着を強化し、壁の張力の増大に対抗すると考えられる。また、20日令以降の大動脈におけるSFの減少や部位による局在の違いは、内皮にかかるズリ応力の変化によって説明できる。これに対し、出生直後の内皮細胞に長いSFが発達している理由については、ズリ応力に対する反応の感度が高い、細胞分裂時にはSFの方が都合が良い、出生前後の大動脈の伸長に関係している、等の可能性が考えられた。
2.腎臓内動脈系内皮細胞におけるAFの局在の多様性 組織内動脈系における局在の違いの観察のため、定圧灌流固定した成体ラット腎臓の凍結切片を、rhodamine-phalloidinで染色し、蛍光顕微鏡で観察した。また、蛍光顕微鏡写真上でAFの長さを測定し、動脈の部位ごとに統計学的な比較を行なった。一部の組織は固定後低温脱水法で処理し、透過型電子顕微鏡で観察した。
腎臓内動脈系のうち、葉間動脈から弓状動脈まで(内径120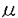 m以上)の比較的太い動脈の内皮細胞は、PBを主に持ち、SFはほとんど認められなかった(PB-pattern)。小葉間動脈近位部(内径30〜100
m以上)の比較的太い動脈の内皮細胞は、PBを主に持ち、SFはほとんど認められなかった(PB-pattern)。小葉間動脈近位部(内径30〜100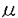 m)ではPBとSFがともに局在していた(PB-SF-pattern)。さらに内径が細い小葉間動脈遠位部から輸入細動脈、さらに輸出細静脈(内径45
m)ではPBとSFがともに局在していた(PB-SF-pattern)。さらに内径が細い小葉間動脈遠位部から輸入細動脈、さらに輸出細静脈(内径45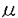 m以下)では、PBは消失してSFのみが走行していた(SF-pattern)。形態計測の結果、SFの線密度は動脈の内径が30
m以下)では、PBは消失してSFのみが走行していた(SF-pattern)。形態計測の結果、SFの線密度は動脈の内径が30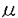 m前後で不連続的に変化し、内径が細い方が有意に大きいことが示された。組織内動脈系において、内皮細胞におけるAFの配置がこのように部位によって次第に変化することを示したのは、ラット腎臓内動脈系を対象にした本研究が初めてである。また、電子顕微鏡による解析から、PBとSFはともに基底側の細胞膜に結合し、細胞外基質に対して細胞を機械的に固定する機能があると考えられた。SFはさらに、長くて核の上を乗り越えるものと、短くて核の基底側を走行するものとに分けられた。
m前後で不連続的に変化し、内径が細い方が有意に大きいことが示された。組織内動脈系において、内皮細胞におけるAFの配置がこのように部位によって次第に変化することを示したのは、ラット腎臓内動脈系を対象にした本研究が初めてである。また、電子顕微鏡による解析から、PBとSFはともに基底側の細胞膜に結合し、細胞外基質に対して細胞を機械的に固定する機能があると考えられた。SFはさらに、長くて核の上を乗り越えるものと、短くて核の基底側を走行するものとに分けられた。
血管壁に対して血圧・血流などが与える力学的な負荷は、動脈の部位によってそれぞれ異なる。腎臓内では、弓状動脈までの太い動脈では脈圧による動脈壁の伸展・変形が想定される。細胞の周囲を細胞外基質に満遍なく固定するPBは、このような力に対抗するのに適していると思われる。これに対し、小葉間動脈遠位部などの細い動脈では脈圧の影響は少なくなり、代わって血流によるズリ応力の影響が大きくなる。血管の長軸方向に張力を発生するSFは、ズリ応力による内皮細胞の剥離・破壊を防ぐのに有利であると考えられる。
結論 本研究により、内皮細胞におけるAFの局在パターンの経時的変化、及び部位による不均一性が明らかとなった。内皮細胞には、血圧や血流によって生じる血行力学的な力も含め、様々な種類の力学的刺激がかかっており、これらの刺激は時々刻々変化している。本研究によって得られたデータから、in vivoの内皮細胞の細胞骨格は、細胞にかかる力学的刺激の違いによって分化している、と考えられる。
in vivoの内皮細胞におけるPBの機能については、従来、細胞間に隙間を開いて血管透過性を調節するという説が有力であった。しかし、この機能は本来、細静脈や毛細血管に固有のものと考えられる。これに対し本研究は、動脈系の内皮細胞におけるPBの機能は、血圧による壁の伸展に対抗して、細胞同志あるいは細胞外基質への接着を強化することにある、という仮説を提唱した。また、本研究によって、同じ動脈内皮細胞でも、大動脈と組織内動脈とではPBの超微細形態が異なることが初めて示され、これらがそれぞれ異なった機能を持っていることが示唆された。
SFの機能については、ズリ応力に対抗して内皮細胞を細胞外基質に固定し、内皮細胞の剥離・破壊を防ぐ、という従来からの考え方がほぼ支持された。しかし、出生直後の内皮細胞におけるSFの局在パターンはズリ応力では説明できず、大動脈の伸長に伴う伸展刺激が関与するものと考えられた。すなわち、血行動態以外の因子もin vivoの内皮細胞におけるAFの局在に影響を与える、と考えなければならないことが示された。
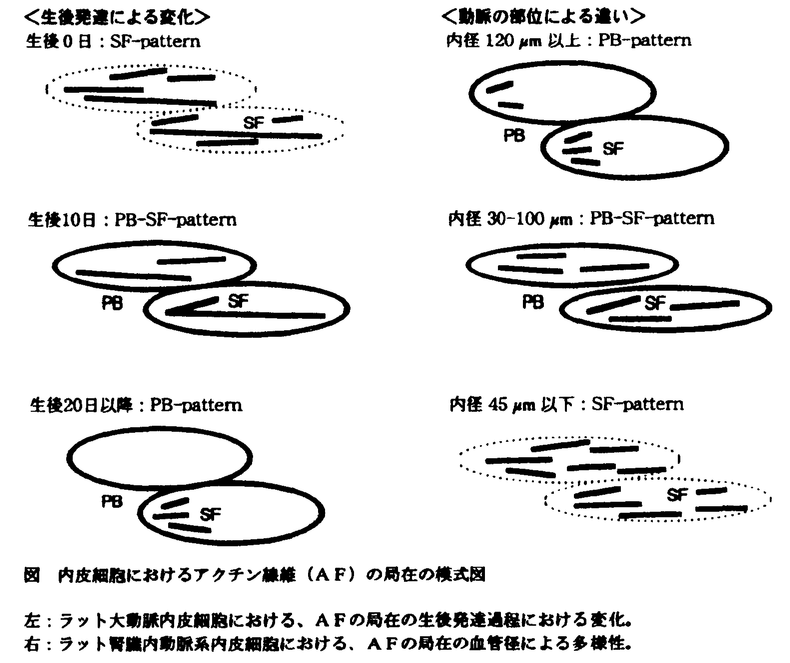 図 内皮細胞におけるアクチン線維(AF)の局在の模式図左:ラット大動脈内皮細胞における、AFの局在の生後発達過程における変化。 右:ラット腎臓内動脈系内皮細胞における、AFの局在の血管径による多様性。
図 内皮細胞におけるアクチン線維(AF)の局在の模式図左:ラット大動脈内皮細胞における、AFの局在の生後発達過程における変化。 右:ラット腎臓内動脈系内皮細胞における、AFの局在の血管径による多様性。