アルギニン・バゾブレッシン(AVP)とエンドセリン-1(ET-1)はアンギオテンシンII(ANG II)とともに強力な血管収縮性物質であることが知られているが、心臓に対する作用に関しては一定の結論を見ていない。AVPの投与は心拍出量を減少させるが、それが心筋に対する直接作用に基づくものか冠血管収縮などに基づく二次的なものかについては議論が分かれている。またET-1についても、心筋に対して陽性変力作用を有するとする研究とそれに対して否定的な研究とがあり未だ結論が出ていない。AVP、ET-1とANG IIは血管平滑筋細胞において共通の情報伝達機構を通じて血管収縮作用を示すとされているが、最近ANG IIが培養心筋細胞の細胞内Ca2+濃度([Ca2+]1)や収縮性を下げるとする研究結果が報告されており、AVPとET-1もやはり心筋細胞に対して同様の作用を示すことが考えられる。そこで本研究ではニワトリ胚培養心室筋細胞を用いて[Ca2+]1と細胞収縮に対するAVPとET-1の影響を検討した。 自発収縮するニワトリ胚心室筋細胞は、10日目のニワトリ胚より心臓を摘出し、トリプシンを用いて心室筋細胞を遊離させ、カバーグラス上で3日間培養することにより作成した。新生児ラット培養心室筋細胞と成体ウサギ単離心筋細胞も同じくカバーグラス上に作成した。作成した心室筋細胞にはCa2+指示薬として5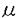 Mの蛍光色素indo-1をloadし、カバーグラスを連続灌流できるchamberにセットして、HEPES-buffered normal Tyrode液で灌流した。蛍光顕微鏡システムを用いて心室筋細胞からの蛍光を測定し、400nmと500nmの蛍光強度の比から[Ca2+]1を計算した。[Ca2+]1の測定と同時にビデオモーション解析装置を用いて心室筋細胞の収縮を測定した。またpH感受性蛍光色素BCECFと蛍光顕微鏡システムを用いて心室筋細胞内のpH(pH1)を測定した。 Mの蛍光色素indo-1をloadし、カバーグラスを連続灌流できるchamberにセットして、HEPES-buffered normal Tyrode液で灌流した。蛍光顕微鏡システムを用いて心室筋細胞からの蛍光を測定し、400nmと500nmの蛍光強度の比から[Ca2+]1を計算した。[Ca2+]1の測定と同時にビデオモーション解析装置を用いて心室筋細胞の収縮を測定した。またpH感受性蛍光色素BCECFと蛍光顕微鏡システムを用いて心室筋細胞内のpH(pH1)を測定した。 実験のプロトコールとしては、まず最初にニワトリ胚培養心室筋細胞に対する100nMのAVPの影響を検討し(n=7)、続いて最近合成された非ペプチド性のAVPV1アンタゴニストのOPC-21268がAVPによる影響を阻害するかどうかを検討した(n=6)。次にニワトリ胚培養心室筋細胞に対する0.1nMから10nMのET-1の影響を検討した(n=12)。次にAVP、ET-1による変化を10nMのANG IIまたは80nMの12-o-tetra-decanoyl-phorbol-13acetate(TPA)による変化と比較した。さらにニワトリ胚心室筋細胞を低Na,"0"-Ca溶液で灌流し、[Ca2+]1に及ぼす10nMのET-1、ANG IIと10mMのcaffeineの影響を検討した。最後に、成体ウサギと新生児ラットの心室筋細胞に対する10nMのET-1の影響と、ニワトリ胚心室筋細胞にET-1を投与したときのpH1の変化も検討した。なお、統計学的にはp<0.05を有意とした。 ニワトリ胚培養心室筋細胞に100nMのAVPを投与すると、60秒以内にsystolic[Ca2+]1と細胞収縮の大きさは軽度ではあるが有意に低下し、収縮頻度は軽度ではあるが有意に上昇した(表1)。 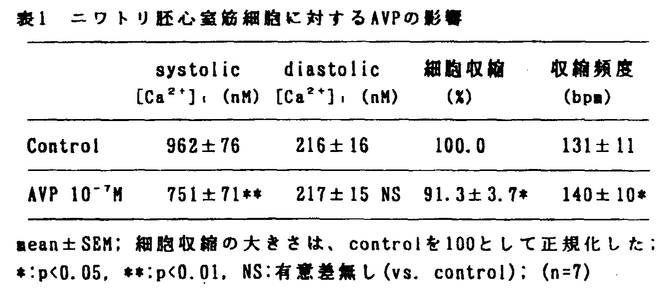 表1 ニワトリ胚心室筋細胞に対するAVPの影響 表1 ニワトリ胚心室筋細胞に対するAVPの影響 一定の周波数2.5Hzでペーシングした心室筋細胞においても、AVP投与によりsystolic[Ca2+]1、細胞収縮の大きさはともに低下し、AVPによるこれらの変化は収縮頻度の増加の結果として起こったものではないことが示された。続いて1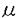 MのV1アンタゴニストOPC-21268を前投与してから100nMのAVPを投与すると[Ca2+]1と細胞収縮は変化せず、ニワトリ胚培養心室筋細胞に対するAVPの作用はV1受容体を介することが示唆された。AVPが生体内で心血管系に対して果たしている生理的な意義に関しては不明な点が多いが、これまでのAVPアンタゴニストがすべてペプチドであり経口活性がないという欠点があったのに対し、本研究において用いた新しいV1アンタゴニストOPC-21268は非ペプチドで経口活性を有するため長期投与等が可能であり、AVPの生理的意義の解明に有用であると考えられた。 MのV1アンタゴニストOPC-21268を前投与してから100nMのAVPを投与すると[Ca2+]1と細胞収縮は変化せず、ニワトリ胚培養心室筋細胞に対するAVPの作用はV1受容体を介することが示唆された。AVPが生体内で心血管系に対して果たしている生理的な意義に関しては不明な点が多いが、これまでのAVPアンタゴニストがすべてペプチドであり経口活性がないという欠点があったのに対し、本研究において用いた新しいV1アンタゴニストOPC-21268は非ペプチドで経口活性を有するため長期投与等が可能であり、AVPの生理的意義の解明に有用であると考えられた。 次に、ニワトリ胚培養心室筋細胞に0.1〜10nMのET-1を投与すると、[Ca2+]1transientsと細胞収縮の大きさは用量依存性に速やかに低下し、1.0nM以上の濃度ではその変化は有意となった。表2に10nMのET-1投与時の各指標の変化を示す。ペーシングした心室筋細胞においてもET-1投与により[Ca2+]1transientsと細胞収縮の大きさはともに低下し、AVPと同様にET-1によるこれらの変化は収縮頻度の増加の結果として起こったものではないと考えられた。 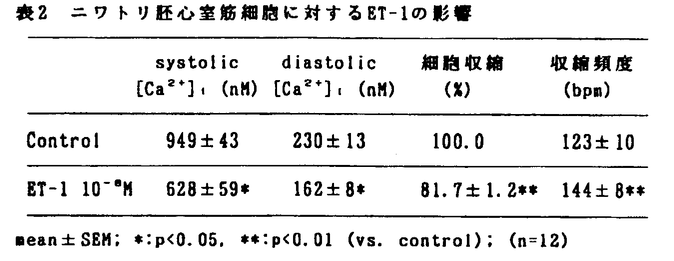 表2 ニワトリ胚心室筋細胞に対するET-1の影響 表2 ニワトリ胚心室筋細胞に対するET-1の影響 次に、ニワトリ胚心室筋細胞に10nMのANG IIまたは80nMのTPAを投与すると、AVP、ET-1の場合と同様に60秒以内に[Ca2+]1transientsと細胞収縮の大きさはともに低下した。ANG IIまたはTPAによって前処置を行った状態でET-1を投与しても、[Ca2+]1transientsと細胞収縮がさらに変化することはなかった。 ANG II、AVP、ET-1が心筋細胞の膜受容体に結合すると、血管平滑筋細胞の場合と同様にphospholipase C(PLC)が活性化され、diacylglycerolとinositol1,4,5-triphosphate(IP3)の二つのメッセンジャーが生ずると考えられている。このうちdiacylglycerolはprotein kinase C(PKC)を活性化するが、心室筋細胞ではPKCが活性化されると[Ca2+]1transientsと細胞の収縮性はともに低下するという研究結果がある。本研究において、PKC activatorであるTPAによって[Ca2+]1transientsと細胞収縮の大きさの低下が観察されたことは、AVPとET-1による変化にPKCの活性化が関与している可能性を示唆する。 次に、ニワトリ胚心室筋細胞を低Na,"0"-Ca溶液で灌流し、細胞膜を通じてのNa-Ca exchangeをできる限り除去した状態では、10nMのET-1またはANG IIを投与しても[Ca2+]1は変化せず、10mMのcaffeineを投与したときのみ[Ca2+]1は一過性に上昇した。この結果はET-1とANG IIが筋小胞体(SR)からCa2+を放出させないという可能性を示唆する。 さらに成体ウサギと新生児ラットの心室筋細胞に対する10nMのET-1の影響を検討したところ、新生児ラットではニワトリ胚心室筋細胞と同様の変化を示したが、成体ウサギ心室筋細胞では、[Ca2+]1transientsが上昇することなしに細胞収縮の大きさが上昇し、細胞の種類によってET-1に対する反応が異なる可能性が示唆された。最後にニワトリ胚心室筋細胞に10nMのET-1を投与したときのpH1の変化を検討したがpH1は有意に変化せず、ET-1による細胞内のアルカローシスは起こらないことが示された。 以上より本研究では次の結論を得た。 1. AVPとET-1はいずれもニワトリ胚培養心室筋細胞の細胞内Ca2+transientsと細胞収縮の大きさを低下させたが、その変化はアンギオテンシンIIによる変化と同様であった。 2. AVPとET-1によるこれらの変化にはprotein kinase Cの活性化が関与していることが示唆された。 |