| 内容要旨 | | 本研究はさまざまな産業分野への利用が期待される高度好熱菌Thermus aquaticus YT-1由来のプロテアーゼ,アクアライシンIを組換え大腸菌により大量に生産すること、くわえて組換え体の増殖特性,培養技術及びそれに関連する培養装置の開発など、大量生産プロセスの確立を目的に行った。 -tacプロモーターによる生産系- アクアライシンI生産のための発現プラスミドpAQNは、pUC由来の複製開始点oriとアンピシリン耐性遺伝子を含んでいる。T.aquaticus YT-1由来のアクアライシンI遺伝子の発現はtacプロモーター/オペレーター及びlacIqの制御下にある。宿主にはE.coli TG1株[ (lac-pro),supE,thi,hsdD5/F’traD36,proAB,lacIq,lacZ (lac-pro),supE,thi,hsdD5/F’traD36,proAB,lacIq,lacZ M15]を用いた。組換え体TG1(pAQN)を用い、まず発現誘導物質isopropyl M15]を用いた。組換え体TG1(pAQN)を用い、まず発現誘導物質isopropyl  -D-thiogalactopyranoside(IPTG)の添加時期及び濃度のアクアライシンI生産に及ぼす影響について検討した。生産量は誘導時の増殖活性と関係があり、対数増殖期の誘導が最も効果的であったが、IPTG0.2mM以上の添加を行っても顕著な増加は見られなかった(図1)。また逐次流加培養において、増殖阻害物質として知られる酢酸の蓄積が観察され、その阻害効果は濃度と密接に関係していた。この酢酸はアクアライシンI生産に対しても強い影響を及ぼし、単位菌体当たりの生産量,YP/Xは4〜8g/lの酢酸添加で無添加の場合の62%にまで低下した。 -D-thiogalactopyranoside(IPTG)の添加時期及び濃度のアクアライシンI生産に及ぼす影響について検討した。生産量は誘導時の増殖活性と関係があり、対数増殖期の誘導が最も効果的であったが、IPTG0.2mM以上の添加を行っても顕著な増加は見られなかった(図1)。また逐次流加培養において、増殖阻害物質として知られる酢酸の蓄積が観察され、その阻害効果は濃度と密接に関係していた。この酢酸はアクアライシンI生産に対しても強い影響を及ぼし、単位菌体当たりの生産量,YP/Xは4〜8g/lの酢酸添加で無添加の場合の62%にまで低下した。 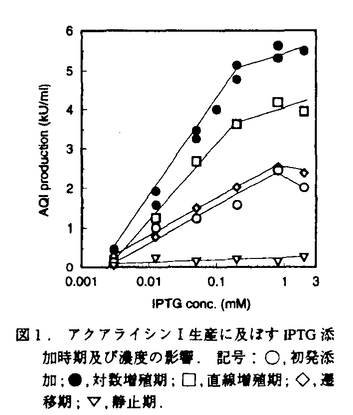 図1.アクアライシンI生産に及ぼすIPTG添加時期及び濃度の影響.記号:〇,初発添加;●,対数増殖期;□,直線増殖期;◇,遷移期;▽,静止期. 図1.アクアライシンI生産に及ぼすIPTG添加時期及び濃度の影響.記号:〇,初発添加;●,対数増殖期;□,直線増殖期;◇,遷移期;▽,静止期. 酢酸蓄積による阻害効果を避けるため、オンライングルコースアナライザーとHPLCユニットによるオンラインモニタリングシステムを構築し(図2)、培地中の酢酸濃度をモニターしながらグルコースの供給速度を変化させる流加培養を行った。酢酸は培養中を通して1g/l以下に保たれ、培養14時間目において菌体濃度が18g/lに達したとき、33.2kU/mlのアクアライシンIが生産された。ここで、アクアライシンI活性は単位時間当たりのカゼイン分解活性であり、280nmにおける吸光度を1分間に0.002上昇させる活性を1Uと定義した。  図2.オンラインモニタリング装置.-T7プロモーターによる生産系- 図2.オンラインモニタリング装置.-T7プロモーターによる生産系- 染色体上のlacUV5プロモーターの制御下に発現するファージT7RNAポリメラーゼ遺伝子を持つ大腸菌JM109(DE3)株(endA1,recA1,gyrA96,thi,hsdR17,(rk-,mk+),relA1,supE44, (lac-proAB),[F’,traD36,proAB,lacIq,lacZ (lac-proAB),[F’,traD36,proAB,lacIq,lacZ M15], M15], (DE3))(F’+株)と、F’エピソームが欠落した大腸菌JM109(DE3)株(F’-株)を宿主として用いた。T7プロモーターとアンピシリン耐性遺伝子を含む発現ベクターpGEMEX-2のT7 gene 10の下流にシグナル配列を持たないアクアライシンI遺伝子ならびにC末端プロ領域に欠失を持つ変異遺伝子を挿入し、pkAQN,pkAQN (DE3))(F’+株)と、F’エピソームが欠落した大腸菌JM109(DE3)株(F’-株)を宿主として用いた。T7プロモーターとアンピシリン耐性遺伝子を含む発現ベクターpGEMEX-2のT7 gene 10の下流にシグナル配列を持たないアクアライシンI遺伝子ならびにC末端プロ領域に欠失を持つ変異遺伝子を挿入し、pkAQN,pkAQN C30,pkAQN C30,pkAQN C105を作成した(図3)。pkAQNを導入した組換え体F’+株を培養しIPTGによる誘導を行ったところ、菌体破砕・遠心分離後の不溶性画分にT7 gene 10タンパク質(26kDa)とアクアライシンI前駆体(48kDa)から成る74kDaのタンパク質の発現が観察された。これは熱処理(75℃,2h)によってもプロセシングされず、生産されたアクアライシンIは活性化されない封入体を形成したものと考えられた。これに対しpkAQNを導入したF’-株を培養した所、IPTG無添加でも約11kU/mlの可溶性アクアライシンIを生産した。この時、アクアライシンIは菌体破砕後の可溶性画分に総活性の80%以上が存在し、膜画分には総活性のわずか2%しか存在しなかった。IPTGの添加効果について検討した結果、ごく低濃度のIPTG(0.0125mM)添加により、無添加の場合の約2.5倍の可溶性アクアライシンIを得た(図4)。高効率発現系として知られるT7プロモーター発現系では、目的生産物はほとんどの場合封入体を形成することが報告されている。ここではlacIq遺伝子をもつF’エピソームを欠落させlacリプレッサーの量を減少させることで、leakyな発現を誘導し、封入体の生成を回避できたものと考えられる。 C105を作成した(図3)。pkAQNを導入した組換え体F’+株を培養しIPTGによる誘導を行ったところ、菌体破砕・遠心分離後の不溶性画分にT7 gene 10タンパク質(26kDa)とアクアライシンI前駆体(48kDa)から成る74kDaのタンパク質の発現が観察された。これは熱処理(75℃,2h)によってもプロセシングされず、生産されたアクアライシンIは活性化されない封入体を形成したものと考えられた。これに対しpkAQNを導入したF’-株を培養した所、IPTG無添加でも約11kU/mlの可溶性アクアライシンIを生産した。この時、アクアライシンIは菌体破砕後の可溶性画分に総活性の80%以上が存在し、膜画分には総活性のわずか2%しか存在しなかった。IPTGの添加効果について検討した結果、ごく低濃度のIPTG(0.0125mM)添加により、無添加の場合の約2.5倍の可溶性アクアライシンIを得た(図4)。高効率発現系として知られるT7プロモーター発現系では、目的生産物はほとんどの場合封入体を形成することが報告されている。ここではlacIq遺伝子をもつF’エピソームを欠落させlacリプレッサーの量を減少させることで、leakyな発現を誘導し、封入体の生成を回避できたものと考えられる。  図3.発現プラスミドpkAQN,pkAQN 図3.発現プラスミドpkAQN,pkAQN C30,pkAQN C30,pkAQN C105の構築.略語:N-pro,N末端プロ配列;C-pro,C末端プロ配列. C105の構築.略語:N-pro,N末端プロ配列;C-pro,C末端プロ配列. C30, C30, C105は前駆体のC末端側からそれぞれ30ならびに105アミノ酸残基が欠失していることを示す.いずれの遺伝子も野生型アクアライシンI遺伝子が持つシグナル配列のコーディング領域を欠失している. C105は前駆体のC末端側からそれぞれ30ならびに105アミノ酸残基が欠失していることを示す.いずれの遺伝子も野生型アクアライシンI遺伝子が持つシグナル配列のコーディング領域を欠失している. 図4.アクアライシンI生産に及ぼすIPTGの添加効果.記号: 図4.アクアライシンI生産に及ぼすIPTGの添加効果.記号: ,IPTG添加後5時間目; ,IPTG添加後5時間目; ,11時間目. ,11時間目. 次にF’-株に3種の発現ベクター,pkAQN,pkAQN C30,そしてpkAQN C30,そしてpkAQN C105(図3)をそれぞれ導入し、アクアライシンI生産に及ぼすC末端プロ配列の影響を検討した(図5)。組換え体F’-株(pkAQN C105(図3)をそれぞれ導入し、アクアライシンI生産に及ぼすC末端プロ配列の影響を検討した(図5)。組換え体F’-株(pkAQN C105)は成熟酵素と同様のタンパク質(28kDa)を生産するためか、培養前半菌体増殖が著しく抑制された。またアクアライシンIはC末端プロ配列の欠損の有無に拘わらずIPTG無添加で生産され、中でも組換え体F’-株(pkAQN C105)は成熟酵素と同様のタンパク質(28kDa)を生産するためか、培養前半菌体増殖が著しく抑制された。またアクアライシンIはC末端プロ配列の欠損の有無に拘わらずIPTG無添加で生産され、中でも組換え体F’-株(pkAQN C30)は培養12時間目に約36kU/mlの可溶性アクアライシンIを生産した。 C30)は培養12時間目に約36kU/mlの可溶性アクアライシンIを生産した。  図5.アクアライシンI生産における3種の組換え体の比較.宿主はF’-JM109(DE3)株.記号:○,pkAQN;□,pkAQN 図5.アクアライシンI生産における3種の組換え体の比較.宿主はF’-JM109(DE3)株.記号:○,pkAQN;□,pkAQN C30; C30; ,pkAQN ,pkAQN C105. C105. 高濃度培養時の酢酸による阻害効果回避のため、炭素源の効果について検討した所、グリセロールはアクアライシンI生産,最終菌体濃度ともに良好で(YP/X=8.50×103kU/g cell)、また酢酸生成もグルコースのそれと比較し1/2以下であった。しかし、資化速度が他のどの炭素源よりも低く、増殖の遅れも観察された。この欠点を補い、利点を生かすため、グルコースとグリセロールを用いる2段階流加培養を行った。酢酸は培養を通して3.2g/l以下に保たれ、菌体濃度が19g/l以上になったとき、152kU/mlの活性アクアライシンIが生産された。 さらに組換え体F’-株(pkAQN C30)を用い、実生産プロセスを念頭に回分培養において培地成分の検討を行った結果、トリプトンと酵母エキスを4倍濃度に高めたLB培地(4LB培地)を使用することにより、高濃度のアクアライシンIが得られた。4LB培地を用い、かつ酢酸の生成を抑制するため、グルコースとグリセロールを初発に添加する2炭素源回分培養を行った。グルコースがまず消費され続いてグリセロールが消費される2段階培養を行った時と同様の現象が観察され、この時酢酸は比較的低レベル(5g/l以下)で推移した。菌体濃度が22g/lに達した時、約200kU/mlのアクアライシンIが生産された(図6)。 C30)を用い、実生産プロセスを念頭に回分培養において培地成分の検討を行った結果、トリプトンと酵母エキスを4倍濃度に高めたLB培地(4LB培地)を使用することにより、高濃度のアクアライシンIが得られた。4LB培地を用い、かつ酢酸の生成を抑制するため、グルコースとグリセロールを初発に添加する2炭素源回分培養を行った。グルコースがまず消費され続いてグリセロールが消費される2段階培養を行った時と同様の現象が観察され、この時酢酸は比較的低レベル(5g/l以下)で推移した。菌体濃度が22g/lに達した時、約200kU/mlのアクアライシンIが生産された(図6)。  図6.F’-JM109(DE3)のpkAQN 図6.F’-JM109(DE3)のpkAQN C30組換え体の2炭素源培養によるアクアライシンIの生産.記号:○,菌体濃度;●,アクアライシンI生産量;■,グルコース;□,グリセロール; C30組換え体の2炭素源培養によるアクアライシンIの生産.記号:○,菌体濃度;●,アクアライシンI生産量;■,グルコース;□,グリセロール; ,酢酸. ,酢酸. 以上、発現誘導条件を始め,オンラインモニタリングシステムの開発,発現プロモーターの変更,2炭素源を用いた流加培養法,また実生産プロセスを考慮した回分培養における培地成分の効果など,培養工学的検討を行うことにより、アクアライシンIを安定にかつ大量に生産することを可能にした。 |
| 審査要旨 | | 本論文は,高度好熱菌Thermus aquaticus YT-1由来の耐熱性プロテアーゼであるアクアライシンIの,組換え大腸菌による大量生産プロセスの確立を目的とし,組換え体の培養のための基礎的知識・技術の蓄積及びそれに関連する培養装置の開発について述べたものであり,5章より構成されている。 第1章と第2章では,tacプロモーターによる発現系について検討している。第1章では,組換え大腸菌TG1株(pAQN)の回分培養における効率的生産のための培養条件について明らかにした。発現誘導剤isopropyl  -D-thiogalactopyranoside(IPTG)の添加時期・濃度はともに生産量に著しく影響を与えた。次に培地成分中,酵母エキスと炭素源の比率について総アクアライシンI生産量と単位酵母エキスあたり生産量を検討した。また培養温度に関し,発現誘導まで37℃で培養し,その後誘導と同時に34〜31℃に温度を移行させる方が生産性が向上することがわかった。これら基礎的培養条件の最適化の結果,以前得られていた生産量に比べ約6倍のアクアライシンIを得た。 -D-thiogalactopyranoside(IPTG)の添加時期・濃度はともに生産量に著しく影響を与えた。次に培地成分中,酵母エキスと炭素源の比率について総アクアライシンI生産量と単位酵母エキスあたり生産量を検討した。また培養温度に関し,発現誘導まで37℃で培養し,その後誘導と同時に34〜31℃に温度を移行させる方が生産性が向上することがわかった。これら基礎的培養条件の最適化の結果,以前得られていた生産量に比べ約6倍のアクアライシンIを得た。 第2章では,大量生産を達成するための流加培養法について,またその際問題となった酢酸の影響について検討した。培養中に生成した酢酸は菌の増殖ならびにアクアライシンI生産に対して強い阻害効果を示した。酢酸生成を抑えるための流加培養条件について検討した結果,溶存酸素濃度(DO)を50%飽和に,グルコース濃度を0.5g/l以下に保つことにより,酢酸の生成が抑えられること,また生成した酢酸と供給するグルコースの濃度が共に低ければ,菌体による酢酸の消費によってその濃度が下げられ低レベルに維持できることが示された。さらに酢酸による阻害効果を抑制するため,グルコース・アナライザーとHPLCによるオンラインモニタリングシステムを構築した。流加培養において,酢酸濃度をモニターしながらグルコースの供給を制御することにより,回分培養の約1.7倍のアクアライシンIを得た。 第3〜5章では,T7プロモーターによる生産系について検討している。第3章では,lac Iq遺伝子を持つF’エビソームを保持した大腸菌JM109(DE3)(F’+)株にpkAQNを導入し,回分培養においてIPTGによる誘導を行ったところ,アクアライシンI前駆体タンパクとT7gene 10タンパクの融合蛋白質が生産され,これは活性を持たない封入体であった。封入体を形成せずかつ高効率に発現させるため,F’エビソームの欠失したJM109(DE3)(F’-)株(pk-AQN)を用いたところ,アクアライシンIがIPTG無添加でも可溶性蛋白質として生産された。 第4章では,アクアライシンI生産における酵素前駆体C末端プロ配列の影響,培養時に問題となる酢酸の生成に及ぼす炭素源の効果等について検討した。JM109(DE3)(F’-)株に3種のプラスミド(野生型遺伝子を持つpkAQN,C末端プロ配列に欠失を持つpkAQN C30とpkAQN C30とpkAQN C105)を導入し,その生産性について検討した。可溶性アクアライシンIはC末端プロ配列の欠失の有無にかかわらずIPTG無添加で生産され,なかでも組換え体F’-株(pkA-QN C105)を導入し,その生産性について検討した。可溶性アクアライシンIはC末端プロ配列の欠失の有無にかかわらずIPTG無添加で生産され,なかでも組換え体F’-株(pkA-QN C30)は培養12時間後に最も高いレベルの可溶性アクアライシンIを生産した。 C30)は培養12時間後に最も高いレベルの可溶性アクアライシンIを生産した。 酢酸による阻害効果回避のため,他の炭素源の利用について検討した結果,グリセロールを用いた場合酢酸が生成されにくいことがわかった。しかし,グリセロールは資化速度が他のどの炭素源よりも遅く,培養前半に増殖の遅れが観察された。そこで,資化の速いグルコースと共にグリセロールを用いる2段階培養を行った。培養前半,菌体はグルコースを資化しながら順調に増殖し,流加培養後半ではグリセロールを良好に資化した。この時,酢酸は培養を通して低レベルに保たれた。 第5章では,組換え体F’-株(pkAQN C30)を用い,実生産プロセスを念頭においた回分培養について検討した。培地中のトリブトン,酵母エキスを4倍に増量した4LB培地を用い,酢酸の生成を抑制するため2炭素源(グルコースとグリセロール)を初発に添加する回分培養を行い,特別な装置を必要とせず,またIPTG無添加で約900mg/l(以前得られていたものに比べ約70倍)のアクアライシンIを得た。 C30)を用い,実生産プロセスを念頭においた回分培養について検討した。培地中のトリブトン,酵母エキスを4倍に増量した4LB培地を用い,酢酸の生成を抑制するため2炭素源(グルコースとグリセロール)を初発に添加する回分培養を行い,特別な装置を必要とせず,またIPTG無添加で約900mg/l(以前得られていたものに比べ約70倍)のアクアライシンIを得た。 以上,本研究は耐熱性プロテアーゼ(アクアライシンI)を,組換え大腸菌を用いて生産することを目的とし,2炭素源を用いた流加培養法,また実生産プロセスを考慮した回分培養,オンラインモニタリングシステムの開発など,培養工学的検討を行い,酵素の大量かつ安定な生産を行う手法を確立したものであり,学術上,応用上貢献するところが少なくない。よって審査委員一同は申請者に博士(農学)の学位を授与してしかるべきものと判定した。 |