学位論文要旨
| No | 212405 | |
| 著者(漢字) | 堺,隆一 | |
| 著者(英字) | ||
| 著者(カナ) | サカイ,リュウイチ | |
| 標題(和) | v-Crkとv-Srcの共通信号媒介分子p130の構造・機能解析 | |
| 標題(洋) | ||
| 報告番号 | 212405 | |
| 報告番号 | 乙12405 | |
| 学位授与日 | 1995.06.28 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第12405号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 細胞の分化増殖に関する細胞内信号伝達機構においてSH2/SH3領域(SH:Src Homology)を介した蛋白質間の直接の結合が重要な役割をしている。特にSH2領域はリン酸化されたチロシン残基を中心としたアミノ酸配列を認識して結合をすることが明らかになり、細胞の増殖因子刺激やがん化などの際に観察されるチロシンキナーゼ活性化に際してチロシンリン酸化依存性に信号を伝える重要な機構と考えられる。SH2保有分子としては、N末の活性調節領域にSH2とSH3を持つSrcをはじめとする非受容体型チロシンキナーゼ群や、SH2とSH3のみをその主構造として持つCrkなどのアダプター分子群などがよく知られているが、それぞれのSH2の標的分子については解析が進んでいないものが多い。 v-Crkによる細胞のトランスフォーメーションに際して著明なチロシンリン酸化を受けv-Crkとin vivoで結合している130kDの蛋白質(p130)が見いだされ、v-CrkのSH2を介する信号媒介分子の候補と考えられた。一方、v-Srcのトランスフォーマントでも、v-Srcによりチロシン残基で著明にリン酸化されv-Srcの主としてSH2と結合していると考えられる約130kDの蛋白質が注目されてきた。これらの癌遺伝子産物による細胞がん化のシグナル伝達を解析する目的で、私はv-Crkと結合するp130の精製ならびに遺伝子クローニングをおこなった。さらにポリクローナル抗体を作成して免疫化学的解析を加えることにより、以下に示すようにp130が独自の構造と機能を持ち、v-Crkとv-Srcの系に共通する新規の信号伝達分子であることが明らかになった。 v-Crkを感染あるいはトランスフォーメーションによりトリ胎児線維芽細胞(CEF)やラット3Y1細胞に導入すると、細胞によりサイズは異なるが125-140kDのブロードなチロシンリン酸化蛋白質が検出され、この蛋白質はv-Crkと共沈される。このブロードなバンドは2次元電気泳動では酸性領域の特定の部位に特徴的な形態のスポットとしてマップされるため単一の蛋白質(p130)と考えられた。各種酵素処理によりp130の移動度の変化を解析した結果、SDS-PAGEにみられるp130の多様性は多くのチロシン残基によるリン酸化が種々の程度に起こっているためであると推定された。 抗体カラムによるp130の精製法に関して多くの条件検討を行ったが、最終的にv-Crkを発現させたラット3Y1細胞(3Y1-Crk)の約3x1010個の細胞溶出液より、抗gag抗体と抗リン酸化チロシン抗体による2段階の抗体カラムを用いてラットp130を精製することに成功した。PVDFメンブレン上に転写した後、切り出した約4 得られた約20のクローンを解析したところ、p130は少なくとも2種類のcDNAからコードされる968ないし874アミノ酸からなる蛋白質であり、SH3領域と15個のSH2結合部位がクラスターをつくる領域(Substrate region:基質領域)を持つ新規の信号伝達分子であることがわかった。p130のN末にあるSH3領域は、よくコンセンサスの保存された新規のSH3で、他のSH3の例にみられるようにグアニンヌクレオチド交換因子(GNRP)を介して下流に特異的なシグナルを伝える可能性がある。基質領域に繰り返し現れるチロシン残基の多くはすぐ上流に1つか2つの酸性アミノ酸(D,E)を持つことからチロシンキナーゼの基質になりやすい。最近示されたようにSH2はリン酸化チロシン残基と結合する際にその後に続く主として3つのアミノ酸を認識して特異的な結合をする。基質領域には9つのYD(V/T)Pモチーフを中心に15ヶの似通ったSH2結合能を持ちうる配列が出現している。このYDxPモチーフは合成ペブチドを用いた実験でCrkやNckの結合配列と考えられ、この領域とCrkが強固に結合していることが示唆される。またその変種モチーフには他のSH2保有蛋白質が結合する可能性がある。このような構造を持つ分子としては、インスリンレセプターのキナーゼ基質であるIRS-1に6回繰り返すYMXMモチーフがあることが知られており、チロシンキナーゼの特異的基質として信号を伝える分子に共通する機構と考えることもできる。更にp130には3カ所ほどプロリンが集中する領域があり、SH2と同時にSH3と結合する可能性もある。このp130蛋白質をCas(Crk-associated Substrate:Crk結合基質)と命名した。 p130の3種類の部分領域のGST(グルタチオンSトランスフェラーゼ)との融合タンパク質に対するポリクローナル抗体を作成し、免疫化学的解析を行った。3種類の抗体はどれも粗精製したp130を鋭敏に認識し、ラット、マウス、ヒトの細胞内のp130を十分検出することがわかった。p130は正常の3Y1細胞では115kDと125kDの主として2本のリン酸化チロシンを含まないバンド(FormA,B)として検出されるが、v-Crkまたはv-Srcでトランスフォームした3Y1細胞(3Y1-Crk,SR-3Y1)では強くリン酸化をうけた125kD以上のブロードなバンドとして検出される(Form C)。ただしリン酸化による移動度のずれはv-Crkとv-Srcの発現系で異なり、両者でリン酸化部位の配置や数の違いがあるものと推測される。これらの細胞においてv-Crkまたはv-Srcを免疫沈降によって落とすと主としてチロシンリン酸化された形のp130が共沈してくる。このことからv-Crkやv-Srcとp130の間にはチロシンリン酸化を介した結合があることが確認された。正常3Y1細胞でもp130で免疫沈降すると微量ながらチロシン残基でリン酸化されたp130を検出することができた。v-Crkまたはv-Srcの発現細胞双方でp130は自己の免疫沈降物のもつキナーゼ活性の大変よい基質となる。またそれぞれの細胞をv-Crkあるいはv-Srcの抗体でキナーゼアッセイを行うとp130と全く同じサイズのリン酸化バンドがみられる。v-Srcのキナーゼアッセイで観察される130kDのメインバンドは従来から報告のあるSrcの主要基質であるので、これとp130(Cas)との異同が問題になる。そこでこの2種類の130kDのリン酸化蛋白質をV8プロテアーゼで部分消化したところ、全く同じ消化パターンが得られた。以上の結果より、p130(Cas)が以前よりv-Srcに結合する主要なリン酸化基質として知られる130kDの蛋白質と同一分子であるという結論を得た。p130分子内のSrcとの結合部位については基質領域との結合も考えられるが、C末側にあるYENSおよびYDYVモチーフはSrcのSH2と結合する配列のコンセンサスを満たし、酸性アミノ酸がそれぞれすぐ上流にあるので、Srcによりリン酸化されSrcのSH2と結合している部位の候補と考えやすい。 p130はv-Srcとv-Crkの導入によりリン酸化され、他の分子とリン酸化に依存した結合をしてシグナルを伝えると考えられる。これまで調べた範囲ではv-fes,v-fms,v-fos,v-raf,v-K-ras,v-erb B,SV40などによる細胞のトランスフォーメーションの際にはチロシンリン酸化が観察されないことからp130は今の所SrcとCrkを介した細胞のがん化に比較的特異的に関与していると考えられる。v-Srcと複合体を作った形のp130をリン酸化するのはやはり強力なv-Srcキナーゼである可能性が高い。v-Crk発現細胞ではリン酸化されたp130とc-Srcとの微量の結合が観察されたため、c-Srcがこの細胞内ではp130をリン酸化している可能性も示唆された。CrkのSH3と結合してCrkをリン酸化することが最近示されたc-AblやSrcファミリーの他のキナーゼの影響も今後解析を進める必要がある。 細胞の分画成分の解析から、p130は正常細胞でリン酸化されていない状態では主として細胞質に存在するが、v-Crk発現細胞でのチロシンでリオ酸化されたフォーム(Form C)は細胞膜・核を含む不溶分画に移動していることが示された。この事実はp130がチロシンリン酸化の有無により細胞内の局在を変え他の分子に信号を伝えることを示唆する。 p130はある種のアダプター分子として働くと考えられるが、構造的にSH3領域に加え、SH2結合配列と考えられるモチーフが全体で15回繰り返して現れる約250アミノ酸の領域を持つことから、Srcファミリーのチロシンキナーゼを含むいくつかのSH2保有分子と同時にあるいは競合的に結合してSH3から下流へのシグナルのON/OFFを決定するようなsignal assembler(信号集積分子)としての役割を持つことが予想される。現在p130と結合する新たな分子の同定も進んでおり、従来結びつかなかった複数の信号伝達系でp130を介した共通する信号経路が見つかることも十分考えられる。 | |
| 審査要旨 | 本研究は、v-Crkおよびv-Srcという2種類の癌遺伝子産物による細胞がん化のシグナル伝達機構を解析する目的で、がん化に際して著明なチロシンリン酸化を受け、同時にこれらの癌遺伝子産物と強固に結合するようになる蛋白質p130の生化学的解析、精製ならびに遺伝子クローニングをおこなった。さらにポリクローナル抗体を作成して免疫化学的解析を加えることにより、以下に示すような事実が明らかになった。 1. v-Crkを感染あるいはトランスフォーメーションによりトリ胎児線維芽細胞(CEF)やラット3Y1細胞に導入すると、細胞によりサイズは異なるが125-140kDのブロードなチロシンリン酸化蛋白質が検出され、この蛋白質はv-Crkと共沈される。このブロードなバンドは2次元電気泳動では酸性領域の特定の部位に特徴的な形態のスポットとしてマップされるため単一の蛋白質(p130)と考えられた。各種酵素処理によりp130の移動度の変化を解析した結果、SDS-PAGEにみられるp130の多様性は多くのチロシン残基によるリン酸化が種々の程度に起こっているためであると推定された。 2. v-Crkを発現させたラット3Y1細胞(3Y1-Crk)の約3x1010個の細胞溶出液より、抗gag抗体と抗リン酸化チロシン抗体による2段階の抗体カラムを用いてラットp130を精製することに成功した。p130のプロテアーゼ断片より6組の部分アミノ酸配列が得ることができ、この情報を元にp130のcDNA全長をクローニングした。p130はN末側の違いにより少なくとも2種類のcDNAからコードされる968ないし874アミノ酸からなる蛋白質であり、SH3領域と15個のSH2結合部位がクラスターをつくる領域(Substrate region:基質領域)を持つ新規の信号伝達分子であることがわかった。このp130蛋白質をCas(Crk-associated Substrate:Crk結合基質)と命名した。 3. p130の3種類のポリクローナル抗体を作成し、免疫化学的解析を行ったところ、p130は正常の3Y1細胞では115kDと125kDの主として2本のリン酸化チロシンを含まないバンドとして検出されるが、v-Crkまたはv-Srcでトランスフォームした3Y1細胞(3Y1-Crk,SR-3Y1)では強くリン酸化をうけた125kD以上のプロードなバンドとして検出されることがわかった。。またv-Crkやv-Srcとp130の間には実際にチロシンリン酸化に依存した結合があることが確認された。これらの細胞においてp130の免疫沈降物の持つ強いキナーゼ活性は、p130を大変よい基質とする。一方SR-3Y1をSrcの抗体で免疫沈降してキナーゼアッセイを行うと、従来から報告のある130kDのSrc結合基質が観察されるが、これはp130と全く同じサイズであり、ペプチダーゼマッピング上も同一分子であることが示された。このことからP130がv-Crkとv-Srcの系に共通する信号伝達分子であるという確証を得た。 4. p130のリン酸化はv-fes,v-fms,v-fos,v-raf,v-K-ras,v-erb B,SV40などによる細胞のトランスフォーメーションの際にはチロシンリン酸化が観察されないことから、p130はSrcとCrkを介した細胞のがん化に比較的特異的に関与していると考えられる。細胞の分画成分の解析から、p130は正常細胞でリン酸化されていない状態では主として細胞質に存在するが、v-Crk発現細胞でのチロシンでリン酸化されたフォームは細胞膜・核を含む不溶分画に移動していることが示された。この事実からp130がチロシンリン酸化の有無により細胞内の局在を変え他の分子に信号を伝えることが示唆された。 以上、本論文によって、1989年より多くの研究者によって観察・報告されながらクローニングにいたらなかった、v-Srcとv-CrkのSH2結合分子p130の分子構造が明らかになったことになる。実際にSrcとCrkのように従来関係がないと考えられてきた系において、単一の分子p130を介した共通する信号経路が見つかったことには大きな意味がある。あわせてp130のシグナル伝達分子として他に類をみないユニークな構造は、今後のSH2/SH3を介したシグナル伝達機構の解明に大きく貢献するものと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50952 |
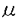 g(30pmol)のp130のプロテアーゼ断片より7から17アミノ酸からなる6組の部分アミノ酸配列が得られた。この情報を元に変性プライマーを用いたRT-PCRを行い、増幅されたDNA断片よりプローブDNAを得た。これを用いてラット3Y1のcDNAライブラリーよりp130のcDNA全長をクローニングした。
g(30pmol)のp130のプロテアーゼ断片より7から17アミノ酸からなる6組の部分アミノ酸配列が得られた。この情報を元に変性プライマーを用いたRT-PCRを行い、増幅されたDNA断片よりプローブDNAを得た。これを用いてラット3Y1のcDNAライブラリーよりp130のcDNA全長をクローニングした。