学位論文要旨
| No | 212414 | |
| 著者(漢字) | 山田,勝成 | |
| 著者(英字) | ||
| 著者(カナ) | ヤマダ,カツシゲ | |
| 標題(和) | Sarcophaga peregrina(flesh fly)の抗菌蛋白質に関する研究 | |
| 標題(洋) | ||
| 報告番号 | 212414 | |
| 報告番号 | 乙12414 | |
| 学位授与日 | 1995.07.12 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(薬学) | |
| 学位記番号 | 第12414号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | センチニクバエの生体防御蛋白質に関する一連の研究から、この昆虫において、主にグラム陰性細菌に抗菌性を持つsarcotoxin I,II,III類、および、グラム陽性細菌に抗菌性を持つsapecinなど数種の抗菌性蛋白質が、体表障害依存的に誘導発現することが明らかにされている。近年、これら抗菌性蛋白質に構造、機能が類似した蛋白質が、昆虫などの無脊椎動物ばかりでなく、高等脊椎動物にも見い出されるようになった。このことから、これら抗菌性蛋白質は、広く生物一般において生体防御機構の一員として重要な役割を演じていると考えられている。これら、抗菌性蛋白質は、抗菌剤としての側面から見た場合生物が本来自分の体内に作り出す物質であることから、毒性が低く、かつ、有効な抗菌剤としての特性を有する事が予想される。また、センチニクバエの抗菌性蛋白質は、比較的分子量が小さく蛋白工学的なアプローチの題材としても興味深い物質であると考えられるが、これまで抗菌活性発現の構造的な本質は明かにされていなかった。そこで、センチニクバエ(Sarcophaga peregrina)の抗菌蛋白質の一次構造の特徴と抗菌活性の相関を調べることによって、活性発現の構造的な本質を明らかにすることができれば、新規な抗菌剤の有用なリード化合物を提供することができ、さらに、抗菌剤のデザインにおいて有用な情報を得るための重要な材料を提供できると考えた。 センチニクバエの抗菌蛋白質であるsarcotoxin Iまたはsapecinの機能発現に重要なアミノ酸残基または領域を推定するための直接的な一つの手法は、これら抗菌タンパク質を遺伝子工学的に発現させる系を確立し、人為的に変異を導入したミュータント蛋白質を作成し解析することである。そこで、まず、すでに単離されていたsarcotoxin IAのcDNAを用いて、組換え型sarcotoxin IAの産生についで検討した。sarcotoxin IAは、バクテリアに対し強い殺菌活性を持つ蛋白質であるため真核細胞の発現系を利用することにした。その結果、カイコ卵巣由来細胞Bombyx mori BM-N cellを宿主とするバキュロウイルスベクター系を利用することで、組換え型sarcotoxin IAを初めて産生させることに成功した。しかしながら、センチニクバエの体液中で見いだされるsarcotoxin IAのカルボキシル末端(C末端)は-Arg-NH2であるのに対して、この系で発現された組換え型sarcotoxin IAのC末端は-Arg-Glyであり、C末端のグリシン残基がアミド化されていなかった。また、この発現系では、組換え型sarcotoxin IAは、プロテアーゼで分解を受けることから、活性のある組換え型sarcotoxin IAを得るためには、システインプロテアーゼ阻害剤を添加する必要があった。本生産系は、sarcotoxin IAのC末端をアミド化する能力を持たないこと、また、プロテアーゼによる分解活性が強いことから、さらに、各種ミュータントsarcotoxin IAを作成するのには必ずしも適しているとは言えなかった。 一方、センチニクバエの胚由来細胞であるNIH-sape-4は、培養上清中にsarcotoxin類や主にグラム陽性菌に対して抗菌活性を持つsapecinを生産し、抗菌タンパク質の生産系としても優れている。この生産系の検討中に、構造上sapecinに類似し、主としてグラム陽性菌に抗菌活性を示す新規な抗菌タンパク質sapecin B,Cを見いだした。SDS-PAGE上でシングルバンドにまで精製した後、Sapecin B,Cのアミノ酸配列とジスルフィド結合の位置を解析した所、sapecin Cは、sapecinと比較して40個のアミノ酸残基中31個のアミノ酸配列が同一であり、かつ、ジスルフィド結合の位置も同じことから、sapecinファミリーに属すると考えられた。 一方、sapecin Bのアミノ酸配列は、図1に示すように、sapecinだけでなくカルシウム依存性K+チャンネル阻害剤として知られているサソリ毒の一種charybdotoxinとも高いホモロジーを持っていることが分かった。 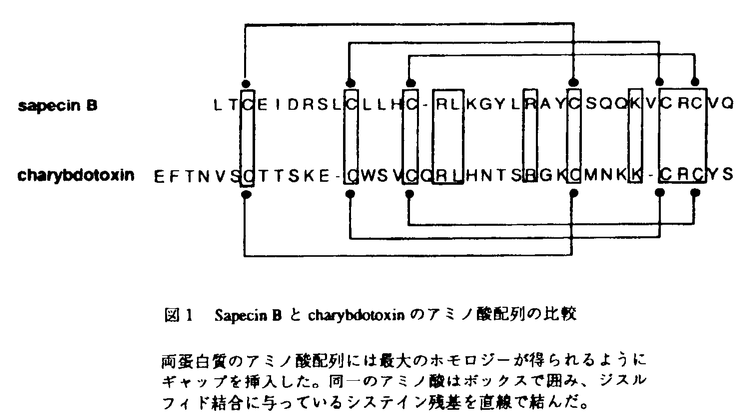 Charybdotoxinの立体構造は詳細に調べられており、分子内にジスルフィド結合で連結された   -ヘリックス領域、29V-34Q fragmentは -ヘリックス領域、29V-34Q fragmentは -シート領域に相当する。29V-34Q fragmentのカルボキシル末端のGlnはアミド化していない。 -シート領域に相当する。29V-34Q fragmentのカルボキシル末端のGlnはアミド化していない。7R-l7K fragmentは、11個のアミノ酸から成るショートペプチドであるから、ある程度立体構造の影響を除外して、アミノ酸配列と抗菌活性の相関を考察することが可能であると考えた。そこで、このペプチドのアミノ酸配列を改変したアナログを合成し抗菌活性を検討した。その結果、N-末端の塩基性アミノ酸の増加や疎水性アミノ酸の導入によって著しく抗菌活性が増強されることを見いだし、最も活性の高いアナログでは、抗菌活性をsapecin Bの約7.5倍に向上させることに成功した。また、これらアナログは、強い界面活性能を持ち界面活性能の強さと抗菌活性の強さの間には正の相関があることを見いだした。しかし、これらペプチドは、酸性リン脂質を含むリポソームを障害する作用を持つにもかかわらず、羊赤血球に対しては顕著な溶血活性を持たなかった。したがって、これら一連の抗菌ペプチドは、親蛋白質sapecin Bの選択毒性の一部を受け継いでおり、抗菌活性の発現において何らかの特異性を持つものと考えられた。 以上、本研究において、センチニクバエの抗菌タンパク質の抗菌活性のコア部分と考えられる配列を初めて決定することに成功し、さらに、アミノ酸配列を改変することで抗菌活性を大幅に向上させることができた。今後、この活性コア部分の細胞膜中での立体構造や、リン脂質、細胞膜蛋白質との相互作用を検討することによって、抗菌活性発現のメカニズムや選択毒性の理解が深まると期待している。したがって、本研究を通じて得られたsapecin Bの活性コア部分は、新しい抗菌剤のデザインにおける有用なリード化合物となると同時に、抗菌タンパク質の研究において新しい局面を開くきっかけになるものと考えている。さらに、このコア部分は、抗菌活性ばかりでなくK+チャンネル阻害剤の研究においても有効なプローブとなる可能性を秘めていると考えられ、この方面での今後の進展にも期待したい。 | |
| 審査要旨 | この論文の構成は3章からなっている。第1章では、昆虫(センチニクバエ)の抗菌性蛋白サルコトキシンIAを、カイコの培養細胞(Bm-N)の中でバキュロウイルスベクターを用いて発現させるシステムについて記載している。この系の特徴は培地中にプロテアーゼ阻害剤PCMBSを添加することで、この薬剤を添加しなければ、産生された蛋白はすべて分解されてしまうが、この薬剤添加により抗菌活性を示す蛋白を大量に培地中につくらせることが可能になった。また、培地中からザルコトキシンIAを精製する方法についても述べている。第2章ではセンチニクバエ胚由来の培養細胞株NIH-Sape-4の培養上清から、抗菌性蛋白ザーペシンのホモログを二種類単離し、ザーペシンBおよびCと命名した。この二つの蛋白はザーペシン同様グラム陽性菌に対して強い抗菌活性を示した。この二つの蛋白の全一次構造を決定したところ、ザーペシンCは40残基よりなり、34残基よりなるザーペシンBに較べてザーペシンとはるかに高い相同性があることが分かった。またザーペシンBにはサソリ毒のカリブドトキシンとも有意の相同性があることが判明した。第3章ではザーペシンBの活性中心の同定を試みている。ザーペシンBは34個のアミノ酸からなるが、N-末端より1 番から6番までのループ部分、7番から17番までのヘリックス部分、18番から28番までと、29番から34番までの二つのシート部分をそれぞれ合成し、もとのザーペシンBと抗菌活性を比較したところ、7番から17番までのヘリックス部分にザーペシンBと見合う活性が見出された。このペプチド(7R-17K)は、MRSAを含むグラム陽性菌だけでなくグラム陰性菌や、ある種の真菌に対しても抗菌活性を示した。このペプチドの構造を種々改変したところ、7R-17Kに較べてはるかに高い抗菌活性を示すペプチド(アミノ酸11残基)の作出に成功した。改変の基本方針は、両末端に主として塩基性のモチーフを置き、それを疎水性のアミノ酸でつなぐというものであった。 以上この研究は、昆虫の生体防御機構の基礎的研究を発展させて、新しい抗菌剤の開発につながる領域を開拓したもので、昆虫免疫学、微生物学の発展に寄与するものであり、博士(薬学)の学位に値するものと判定した。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50953 |