有機合成化学の分野では様々な遷移金属化合物が反応試剤として利用されているが,筆者は,これまで有機合成にほとんど利用されたことがない遷移金属の一つであるレニウムに着目し,レニウム化合物を利用する新しい触媒反応の開発を目的に研究を行なった。その結果,高原子価レニウム化合物である過レニウム酸テトラブチルアンモニウム(Bu4NReO4)を用い,アリルアルコール類の触媒的1.3-転位反応,触媒的Beckmann転位反応,オキシムの分子内環化による新規複素環形成反応を開発することができた。また,低原子価レニウム化合物の反応についても検討したところ,プロモペンタカルボニルレニウム(Re(CO)5Br)がLewis酸として作用することを見出し,これがFriedel-Craftsアシル化反応の触媒として有効であることを明らかにした。
I)過レニウム酸テトラブチルアンモニウム(Bu4NReO4)を用いる触媒反応の開発 アリルアルコール類の触媒的1,3-転位反応: アリルアルコールに対し触媒量のBu4NReO4とp-トルエンスルホン酸(p-TsOH・H2O)をジクロロメタン中で作用させると,室温下で1,3-転位反応が進行することを見いだした。この反応は平衡反応であり,原料および転位生成物の両アリルアルコールの平衡混合物となる。また,水素結合や共役などにより転位生成物が熱力学的に安定になる場合には,優先的に転位生成物を得ることが可能である(式2)。

一方,3級のアリルアルコールの反応では,転位反応に優先して脱水反応が進行し,共役ジエンが良好な収率で生成する。
アリルアルコールに代え,プロパルギルアルコールを基質として用いた場合にも触媒的に1,3-転位反応が進行し, ,
, -不飽和カルボニル化合物を収率良く得ることができる(式3)。従来,プロパルギルアルコールの1,3-転位反応には百数十度の高温を必要とし,また2級のプロパルギルアルコールには適用できないといった制約があったが,本反応は2級のプロパルギルアルコールを基質とした場合にも,良好な収率で対応する
-不飽和カルボニル化合物を収率良く得ることができる(式3)。従来,プロパルギルアルコールの1,3-転位反応には百数十度の高温を必要とし,また2級のプロパルギルアルコールには適用できないといった制約があったが,本反応は2級のプロパルギルアルコールを基質とした場合にも,良好な収率で対応する ,
, -不飽和カルボニル化合物を合成することができる。
-不飽和カルボニル化合物を合成することができる。

なお,アリルアセタート,プロパルギルアセタートを基質として用いた場合には転位反応が進行しないことから,本反応は,Bu4NReO4とp-TsOH・H2Oとから平衡的に生じる過レニウム酸(HReO4)とアルコールとの間で,過レニウム酸エステルが生成することにより進行していると考えられる。
触媒的Beckmann転位反応:Beckmann転位反応はアミド,ラクタムの合成法として,合成化学上極めて重要な反応である。しかし,従来のBeckmann転位反応は大過剰の酸を必要とするため大量の塩が副生するなどの問題点があり,触媒的な手法の開発が強く望まれている。
Bu4NReO4と酸をオキシムに作用させれば,まずオキシムの過レニウム酸エステルが生成した後に,直ちに過レニウム酸の脱離が起こり,Beckmann転位反応が触媒的に進行するものと考えられる。そこで,基質として4-フェニルシクロヘキサノンオキシムを用い,種々の反応条件下,Beckmann転位を試みた。その結果,触媒量のBu4NReO4とトリフルオロメタンスルホン酸を用い,ニトロメタン還流下反応を行った場合に,良好な収率で対応するラクタムが生成することを見いだした。しかし,この反応条件下では,系内に若干量存在する水によりオキシムの加水分解も同時に起こり,ケトンが副生する。そこで,塩酸ヒドロキシルアミンを添加し反応を行ったところ,ラクタムの収率が向上することがわかった。さらに,共沸条件下水を除去しながら反応を行うことにより,反応時間が短縮されることも明らかとなった(式4)。本反応は,芳香族ケトンオキシム,脂肪族ケトンオキシムのいずれに対しても適用可能であり,対応するアミドを高い収率で得ることができる。

上述した反応では,副生するケトンを塩酸ヒドロキシルアミンによりオキシムへと変換させ反応を行った。従って,ケトンと塩酸ヒドロキシルアミンとを出発原科に用いれば,オキシム化.Beckmann転位反応を一段階で行えるものと期待される。実際,種々のケトンに対し,塩酸ヒドロキシルアミン存在下,触媒量のBu4NReO4とCF3SO3Hを作用させると,対応するアミドを一挙に合成することができる(式5)。

オキシムの分子内環化による新規複素環形成反応:上記Beckmann転位反応の検討中,ベンジルアセトンオキシムを基質として用い反応を行った場合,Beckmann転位生成物であるアミドに加え,2-メチルキノリンが副生することを見いだした(式6)。

これまで,Beckmann転位反応により生成するニトリリウムイオンに対し炭素求核試剤の付加反応を行った報告例は多数あるが,Beckmann転位反応に優先してオキシムの窒素原子上で置換反応が進行した例はほとんどない。そこで,このオキシムの窒素原子上での分子内環化反応について,詳細に検討を行った。
まず,フェニル基上に電子供与性基を有するベンジルアセトンオキシム誘導体を用い,種々の条件下反応を試みたところ,基質に対し,等モル量ずつのBu4NReO4とCF3SO3Hをジクロロエタン還流下で作用させることにより,環化体であるキノリン,およびテトラヒドロキノリンが得られることが明らかとなった(式7)。
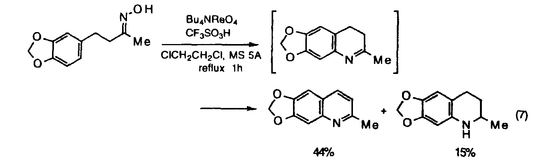
本反応では環化反応により,まずジヒドロキノリンが生成し,これが酸化され,キノリンが生成していると考えられる。このジヒドロキノリンの酸化に,レニウム触媒が消費されてしまうことが考えられたので,次に酸化剤の存在下で本反応を試みることとした。種々の酸化剤を添加し反応を行ったところ,クロラニルを用い反応を行った場合,触媒量のBu4NReO4を用いるだけで,テトラヒドロキノリンの副生を伴うことなく,良好な収率でキノリンが生成することを見いだした(式8)。

本反応では,芳香環上にメチレンジオキシル基,m-メトキシル基,p-カルバモイル基を有するオキシム,および側鎖上にアルキル置換基を有するオキシムを用いることができ,それぞれ対応するキノリン誘導体を良好な収率で合成できる。
一方,パラ位にメトキシル基,ヒドロキシル基を有するベンジルアセトンオキシム誘導体を用いた場合には,アザスビロジエノンが良好な収率で生成することがわかった。また,得られたアザスピロジエノンはニトロベンゼン中,120℃でトリフルオロメタンスルホン酸を作用させることにより,キノリン誘導体に転位することを見いだした(式9)。

以上のように,レニウム化合物を利用することにより,オキシムの窒素原子上での置換反応を見いだし,キノリン,およびアザスピロジエノン誘導体の合成に利用できることを明らかにした。このような複素環化合物はアルカロイドなどの基本骨格として重要な化合物であり,本反応は,これら複素環骨格の合成法として,新しい手法を提供するものである。
II)ブロモペンタカルボニルレニウム(Re(CO)5Br)を用いる触媒反応の開発 触媒的Friedel-Craftsアシル化反応: Friedel-Craftsアシル化反応は,芳香族ケトン類の合成法として極めて有用な反応である。この反応は通常Lewis酸の存在下進行するが,Lewis酸は生成物であるケトンに配位してしまうため,この反応を触媒的に行うことは難しい。これまで,Friedel-Craftsアシル化反応の触媒化に関する試みはいくつかなされ,反応性の高いアニソール,メシチレンに関しては有効な触媒的手法が見いだされている。しかし,これらより反応性の低い,トルエン,キシレンなどにも有効な触媒的アシル化法はほとんど報告例がない。
筆者は,プロモペンタカルボニルレニウム(Re(CO)5Br)が,Friedel-Craftsアシル化反応の触媒として有効であることを見いだした。すなわち,種々の酸塩化物とトルエン,キシレン,アニソールに対し,触媒量のRe(CO)5Brを加熱還流中作用させることにより,対応する芳香族ケトンを高収率で,また,高いパラ選択性で合成することができる(式10)。本反応は,トルエン,キシレンなどのアシル化も効率よく行うことができる点で,従来法に比べ応用性の広い触媒的Friedel-Craftsアシル化法である。
