| 内容要旨 | | ビタミンD代謝物は、正常の骨およびカルシウム(Ca)代謝に必須であり、1,25水酸化ビタミンD3[1,25(OH)2D3]の骨、Ca調節ホルモンとしての役割は確立されている。一方、24R,25水酸化ビタミンD3[24R,25(OH)2D3]は、生体内では1,25(OH)2D3よりはるかに多量に存在するにも拘らず、その生理的役割については疑問の点が多かった。我々は既に、24R,25(OH)2D3が1,25(OH)2D3の代謝・分解過程を促進することから、少なくとも1,25(OH)2D3の代謝を介してはCa代謝に影響し得ることを報告した1)2)。さらに近年、24R,25(OH)2D3をラット3)、ウサギ4)5)およびビーグル犬6)に投与することにより、骨量や骨強度の増加とともに破骨細胞数、骨吸収面の減少がもたらされることが報告された。これらの成績は、24R,25(OH)2D3が破骨細胞の形成や機能に抑制的に作用する可能性を示すものである。しかしながら、破骨細胞の形成や機能は1,25(OH)2D3によって促進されるため、これらのin vivoの成績は、24R,25(OH)2D3が1,25(OH)2D3の代謝に及ぼす作用によって惹起されているとも解釈できる。そこで本研究は、24R,25(OH)2D3がin vitroで破骨細胞の形成および機能に及ぼす効果を検討することにより、24R,25(OH)2D3が固有の骨、Ca代謝に関する作用を有しているかどうかを明かにすることを目的とした。 従来の研究により、破骨細胞は血液幹細胞の分化・融合により形成されることが明らかにされている7)。また、この破骨細胞形成のin vitroでのモデルとして、5-fluorouracilを投与したラットの脾細胞をinterleukin-3(IL-3)とinterleukin-6の存在下で培養し、得られた芽球コロニーをさらにIL-3存在下で培養することによって多核細胞(multinucleated cell:MNC)を形成させる系が確立された8)。この実験系で産生されるMNCは、酒石酸抵抗性酸性フォスファターゼ(tartrate-resistant acid phosphatase:TRAP)やカルシトニン(CT)受容体などの破骨細胞のマーカーを有すること、また間葉系細胞と共に培養することにより、実際に骨吸収をおこすことが確認されている。 1,25(OH)2D3やヒト副甲状腺ホルモンN端フラグメント[PTH(1-34)]は、この系におけるMNC形成を用量依存性に増強した。最小有効濃度は1,25(OH)2D3では10-10M、PTH(1-34)では10-9Mであり、ともに10-8Mで最大効果を発揮した。これに対し10-7M以下の24R,25(OH)2D3は、単独ではMNC形成に影響を及ぼさなかったが、10-6Mの24R,25(OH)2D3は、MNCの形成をわずかに促進した。本実験系におけるMNC前駆細胞の1,25(OH)2D3受容体に対する24R,25(OH)2D3の結合親和性は、1,25(OH)2D3のそれの約2800分の1であった。従って、10-6Mの24R,25(OH)2D3のMNC形成に対する作用は、24R,25(OH)2D3が有する弱い1,25(OH)2D3様作用に由来するものである可能性が考えられた。一方、24R,25(OH)2D3を1,25(OH)2D3やPTH(1-34)と共に添加すると、1,25(OH)2D3やPTH(1-34)により促進されるMNCの形成は、用量依存性に抑制された(図1)。また、10-6Mの24R,25(OH)2D3の添加により、10-6Mの1,25(OH)2D3により促進されるMNC形成は、10-6Mの24R,25(OH)2D3単独添加と同様のレベルにまで低下した(図1)。さらに、この実験系で産生される細胞のCT受容体の数をbinding assayにより検討した結果、10-8の1,25(OH)2D3による著明なCT受容体数の増加は、10-6Mの24R,25(OH)2D3の同時添加によりほぼ完全に抑制されることも明らかとなった。従って、24R,25(OH)2D3は、1,25(OH)2D3およびPTH(1-34)により促進される破骨細胞形成を抑制することが明かとなった。 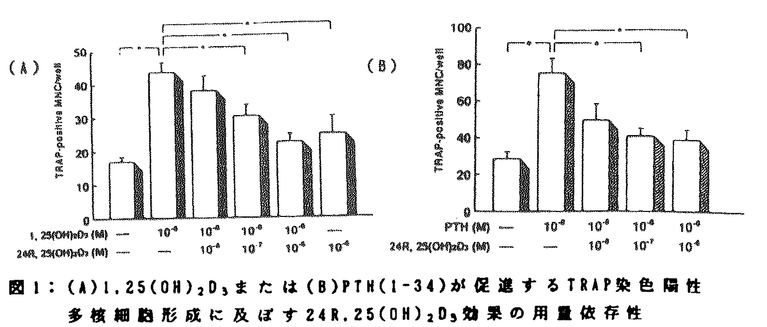 図1:(A)1,25(OH)2D3または(B)PTH(1-34)が促進するTRAP染色陽性多核細胞形成に及ぼす24R,25(OH)2D3効果の用量依存性 図1:(A)1,25(OH)2D3または(B)PTH(1-34)が促進するTRAP染色陽性多核細胞形成に及ぼす24R,25(OH)2D3効果の用量依存性 次いで、これらの破骨細胞形成の抑制作用が24R,25(OH)2D3に特異的なものであるのかどうかを明らかにするために、25-水酸化ビタミンD3[25(OH)D3]、および24R,25(OH)2D3の非活性型光学異性体である24S,25-水酸化ビタミンD3[24S,25(OH)2D3]の破骨細胞形成に及ぼす効果を検討した。その結果、10-6Mの25(OH)D3は、単独ではわずかにMNC形成を促進したが、同濃度の24S,25(OH)2D3はMNC形成に影響を及ぼさなかった。25(OH)D3の1,25(OH)2D3受容体に対する親和性は、1,25(OH)2D3のそれの約330分の1であったことから、高濃度の25(OH)D3のMNC形成に対する作用は、24R,25(OH)2D3の場合と同様1,25(OH)2D3受容体を介するものと解釈された。一方、これらのビタミンD代謝物を10-8Mの1,25(OH)2D3と共に添加した場合には、1,25(OH)2D3によるMNC形成の促進は全く抑制されなかった。従って24R,25(OH)2D3によるMNC形成抑制作用は、他のビタミンD代謝物には認められない特異的なものであることが示された。 さらに破骨細胞による骨吸収は、破骨細胞の形成ばかりではなく形成された破骨細胞の活性によっても調節される。そこで我々は、マウスの大腿骨および脛骨から得られた破骨細胞を象牙質の薄片上で種々のホルモンと共に5日間培養し形成された吸収窩を測定する系を用い、24R,25(OH)2D3が破骨細胞の活性に及ぼす効果を検討した。本実験期間中に作製される吸収窩の大部分は、新たに形成される破骨細胞によるものではなく、既に存在した破骨細胞の活性化によるものであることが確認されている。1,25(OH)2D3、およびPTH(1-34)は、本実験系の吸収窩の数、および面積を用量依存性に増加し、それぞれ10-8Mで最大効果を発揮した。24R,25(OH)2D3は単独ではこれらの指標に影響を及ぼさなかったが、10-8Mの1,25(OH)2D3やPTH(1-34)による吸収窩数、面積の増加を用量依存性に抑制した(図2)。従って24R,25(OH)2D3は、1.25(OH)2D3やPTH(1-34)による破骨細胞の活性化にも抑制的に作用することが明かとなった。これらの24R,25(OH)2D3の作用の詳細な機序については未だ不明であるが、24R,25(OH)2D3は、1,25(OH)2D3のみならずPTH(1-34)の作用にも拮抗的に作用することから、1,25(OH)2D3の代謝に対する作用のみでは説明できない。 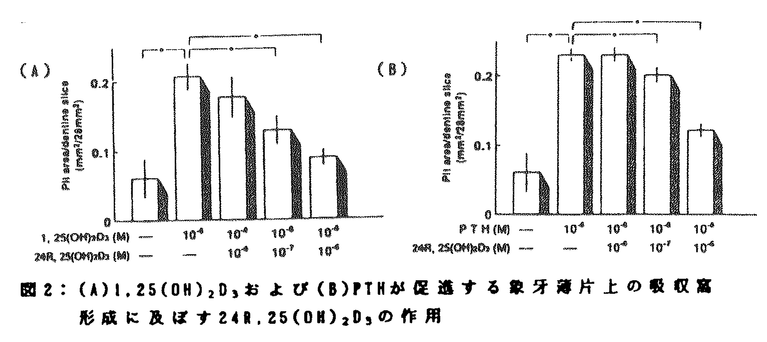 図2:(A)1,25(OH)2D3および(B)PTHが促進する象牙薄片上の吸収窩形成に及ぼす24R,25(OH)2D3の作用 図2:(A)1,25(OH)2D3および(B)PTHが促進する象牙薄片上の吸収窩形成に及ぼす24R,25(OH)2D3の作用 以上本研究は、24R,25(OH)2D3が1,25(OH)2D3やhPTH(1-34)による破骨細胞形成の促進や破骨細胞の活性化を抑制することを明かにし、24R,25(OH)2D3が骨・Ca代謝に対する特異的な作用を有している可能性を示した。従って、従来主に非活性物質への代謝回路として考えられていた25(OH)D3から24R,25(OH)2D3への変換は、新たな活性物質の産生という意味を有することとなる。1,25(OH)2D3は、腎臓ばかりではなく骨を含む他の組織においても24R,25(OH)2D3の産生を促進することから、骨局所における24R,25(OH)2D3濃度は、血中濃度よりさらに高い可能性がある。24R,25(OH)2D3が1,25(OH)2D3の代謝を促進するという我々の報告や今回の成績は、Ca代謝調節ホルモンが相互にその代謝や作用に影響をおよぼしあっていること、さらに24R,25(OH)2D3が標的細胞、特に骨におけるCa調節ホルモンの作用の制御に重要な役割を果たしていることを示唆するものである。今後、24R,25(OH)2D3の新たな作用やその機序が明らかにされることにより、Ca調節ホルモンの作用や骨代謝調節の詳細な機構が解明されるものと考えられる。 造血幹細胞は、5-FU処置BDF1マウス脾臓より得た。これをIL-3およびIL-6を含む1.2%メチルセルロース/ -MEM培地で5日間培養した。ここで形成された芽球コロニーよりblast cellを釣り上げ、この細胞をマイクロプレート(2×103 cells/well)中で、さらに5日間培養した。これに1,25(OH)2D3(A)、PTH(1-34)(B)を単独、あるいは各種濃度の24R,25(OH)2D3と同時添加し、4日間培養した後TRAP染色を行なった。このTRAP染色陽性で核が3個以上のMNCを顕微境下で計測した。結果は平均値士標準誤差(n=4)で示した。*:p<0.05(1,25(OH)2D3(A)、PTH(1-34)(B)単独群との比較) -MEM培地で5日間培養した。ここで形成された芽球コロニーよりblast cellを釣り上げ、この細胞をマイクロプレート(2×103 cells/well)中で、さらに5日間培養した。これに1,25(OH)2D3(A)、PTH(1-34)(B)を単独、あるいは各種濃度の24R,25(OH)2D3と同時添加し、4日間培養した後TRAP染色を行なった。このTRAP染色陽性で核が3個以上のMNCを顕微境下で計測した。結果は平均値士標準誤差(n=4)で示した。*:p<0.05(1,25(OH)2D3(A)、PTH(1-34)(B)単独群との比較) 9日齢ICRマウスの長管骨から得られた破骨細胞を含む細胞5x105cells/wellをマイクロプレート中の象牙薄片上で2時間培養した後、1,25(OH)2D3(A)、PTH(1-34)(B)単独あるいはこれらとともに各種濃度の24R,25(OH)2D3を同時添加した。5日間培養した後、象牙薄片上の細胞を取り除き、酸性haematoxylin染色を行ない、顕微鏡下で接眼ネットマイクロメータディスクを用い、酸性haematoxylin染色された象牙薄片上吸収窩を計測した。結果は平均値士標準誤差(n=5)で示した。*:p<0.05(1,25(OH)2D3(A)、PTH(1-34)(B)単独群との比較) 文献1) Matsumoto T,Ikeda K,Yamato H,Morita K,Ezawa I,Fukushima M,Nishii Y,Ogata E.1988 Effect of 24,25-dihydroxyvitamin D3 on 1,25-dihydroxyvitamin D3 metabolism in calcium-deficient rats.Biochem J 250:671-6772) Yamato H,Matsumoto T,Fukumoto S,Ikeda K,Ishizuka S,Ogata E.1989 Effect of 24,25-dihydroxyvitamin D3 on 1,25-dihydroxyvitamin D3[1,25(OH)2D3]metabolism in vitamin D-deficient rats infused with 1,25(OH)2D3.Endocrinology 124:511-5173) Nakamura T,Kurokawa T,Orimo H 1989 Increased mechanical strength of the vitamin D-replete rat femur by the treatment with a large dose of 24R,25(OH)2D3.Bone 10:117-1234) Nakamura T,Hirai T,Suzuki K,Orimo H 1992 Osteonal remodeling and mechanical properties of the femoral cortex in rabbits treated with 24R,25(OH)2D3.Calcif Tissue Int 50:74-795) Nakamura T,Suzuki K,Hirai T,Kurokawa T,Orimo H 1992 Increased bone volume and reduced bone turnover in vitamin D-replete rabbits by the administration of 24R,25(OH)2D3.Bone 13:229-2366) Nakamura T,Nagai Y,Yamato H,Suzuki K,Orimo H.1992 Regulation of bone turnover and prevention of bone atrophy in ovariectomized beagle dogs by the administration of 24R,25(OH)2D3.Calcif Tissue Int 50:221-2277) Suda T,Takahashi N,Martin TJ 1992 Modulation of osteoclast differentiation.Endocrine Rev 13:66-808) Kurihara N,Suda T,Miura Y,Nakauchi H,Kodama H,Hiura K,Hakeda Y,Kumegawa M 1989 Generation of osteoclasts from isolated hematopoietic progenitor cells.Blood 74:1295-1302 |
| 審査要旨 | | 本研究は、ビタミンD3の主要代謝物のひとつである24R,25(OH)2D3が、固有の骨、カルシウム代謝に対する作用を有しているか否かを解明するために、24R,25(OH)2D3の骨代謝回転、とりわけ破骨細胞の形成や骨吸収能に及ぼす作用を検討することを目的とし、in vitroでの造血幹細胞からの破骨細胞様細胞の形成、およびマウス長管骨由来の破骨細胞の骨吸収機能に及ぼす作用の検討を試みたものであり、下記に示す結果を得ている。 1. 5-fluorouracilを投与したラットの脾細胞をinterleukin(IL)-3とIL-6の存在下で培養し、得られた芽球コロニーをさらにIL-3存在下で培養することによって酒石酸抵抗性酸性フォスファターゼ(tartrate-resistant acid phosphatase:TRAP)やカルシトニン受容体を有する多核細胞(multinucleated cell:MNC)を形成させる系を用い、1,25(OH)2D3やヒト副甲状腺ホルモンN端フラグメント[PTH(1-34)]が促進するTRAP陽性MNCの形成に及ぼす24R,25(OH)2D3の作用を検討した。その結果、24R,25(OH)2D3を1,25(OH)2D3やPTH(1-34)と共に添加すると、1,25(OH)2D3やPTH(1-34)により促進されるTRAP陽性MNCの形成は、用量依存性に低下した。従って、24R,25(OH)2D3は、1,25(OH)2D3およびPTH(1-34)により促進される破骨細胞形成を抑制するが事が示された。 2. これらの破骨細砲形成の抑制作用が24R,25(OH)2D3に特異的なものであるか否かを明らかにするために、25(OH)D3および24R,25(OH)2D3の非活性型光学異性体である24S,25(OH)2D3についても同様な検討を加えた。その結果、いずれのビタミンD3代謝物においてもTRAP陽性MNC形成に影響を及ぼさなかった。従って24R,25(OH)2D3によりもたらされるTRAP陽性MNC形成抑制作用は、他のビタミンD3代謝物には認められない24R,25(OH)2D3固有の特異的なものである事が示された。 3. さらに、マウス長管骨から得られた破骨細胞を含む全細胞を象牙質の薄片上で培養し、形成された吸収窩を測定する系を用いて、24R,25(OH)2D3が破骨細胞の活性に及ぼす効果を検討した。その結果、24R,25(OH)2D3単独処理では破骨細胞の骨吸収機能に明かな影響を及ぼさなかったが、1,25(OH)2D3やPTH(1-34)による吸収窩数、面積の増加を用量依存性に抑制した。また、24R,25(OH)2D3の主代謝物である24-oxo-25(OH)2D3にはこのような作用は認められなかった。従って、24R,25(OH)2D3は、1,25(OH)2D3やPTH(1-34)による破骨細胞の骨吸収機能の活性化にも抑制的に作用する事が示された。 4. このような24R,25(OH)2D3の作用の機序に関しては、in vivoにおける24R,25(OH)2D3の1,25(OH)2D3代謝分解過程の促進作用が、in vitro培養系においても起こり得るか検討したところ、1,25(OH)2D3と24R,25(OH)2D3を同時添加すると、培養液中の1,25(OH)2D3濃度が約30%低下した。このことは、1,25(OH)2D3による骨吸収促進作用を、24R,25(OH)2D3が抑制する一つの機序である可能性と考えられた。 5. さらに、24R,25(OH)2D3が細胞内情報伝達機構に関与するか否かの可能性について検討する目的で、破骨細胞の骨吸収が低下する際、細胞内濃度の上昇が報告されているcGMPの測定を行った。その結果、24R,25(OH)2D3は、単独あるいは1,25(OH)2D3やPTHの同時添加でも、骨由来の細胞において細胞内cGMPの上昇が認められたことから、少なくとも24R,25(OH)2D3の骨吸収抑制作用の一部は、細胞内cGMP上昇を介する可能性が考えられた。 以上、本論文は24R,25(OH)2D3が破骨細胞の形成、および破骨細胞の骨吸収能に対して抑制的に働く特異的な作用を有する事を明らかにした。本研究は、これまで否定的であった24R,25(OH)2D3の骨代謝調節作用について、新たな知見を見いだし、さらにその作用機構の解明に今後重要な貢献をなすものと考えられ、学位の授与に値するものと考えられる。 |