| 内容要旨 | | ペプチドグリカンは細菌の細胞壁を構成する物質で、強固な層状の巨大分子を形成して、崩れやすい細胞質膜で囲まれた内部構造を外部環境から保護し、菌の正常な形態を保つ役割を果たしている。細胞壁分解酵素のうち自己のペプチドグリカンを開裂する酵素は自己溶解酵素(autolysin)と定義され、ペプチドグリカンの構造を修飾することによって、細菌の増殖に深く関わっていると推測されている。 黄色ブドウ球菌(Staphylococcus aureus)は、グラム陽性球菌に属し、ヒトに病原性を示す臨床上重要な菌種であり、また近年多くの抗生物質に耐性を示すメチシリン耐性黄色ブドウ球菌(MRSA)が蔓延し大きな社会的問題となっている。筆者は -ラクタム系抗生物質によって誘発されるS.aureusの自己溶解のメカニズムに興味を持ち、S.aureusの自己溶解酵素について研究を進めることにした。その結果、自己溶解酵素遺伝子のクローニングと構造解析に成功し、それが2種の分泌型細胞壁分解酵素を1つのペプチド上に持つ二頭酵素であることを明かにした。さらにこの酵素が娘細胞の分離という生理的に重要な役割を担っていることを明かにした。 -ラクタム系抗生物質によって誘発されるS.aureusの自己溶解のメカニズムに興味を持ち、S.aureusの自己溶解酵素について研究を進めることにした。その結果、自己溶解酵素遺伝子のクローニングと構造解析に成功し、それが2種の分泌型細胞壁分解酵素を1つのペプチド上に持つ二頭酵素であることを明かにした。さらにこの酵素が娘細胞の分離という生理的に重要な役割を担っていることを明かにした。 S.aureusはendo- -N-acetylglucosaminidase(GL)、N-acetylmuramyl-L-alanineamidase(AM)、さらにglycine endopeptidaseの3種類の異なるペプチドグリカン分解酵素活性をもつことが報告されている。S.aureusの産生する細胞壁分解酵素は主に菌培養液から精製され、AM及びGLに関しいくつかの報告がある。しかし、このうちどれが自己溶解酵素であるのか、これらの酵素の機能は何であるかはあまりわかっていなかった。また、S.aureusのもつ自己溶解酵素遺伝子のクローニングに関する報告はまったくなかった。 -N-acetylglucosaminidase(GL)、N-acetylmuramyl-L-alanineamidase(AM)、さらにglycine endopeptidaseの3種類の異なるペプチドグリカン分解酵素活性をもつことが報告されている。S.aureusの産生する細胞壁分解酵素は主に菌培養液から精製され、AM及びGLに関しいくつかの報告がある。しかし、このうちどれが自己溶解酵素であるのか、これらの酵素の機能は何であるかはあまりわかっていなかった。また、S.aureusのもつ自己溶解酵素遺伝子のクローニングに関する報告はまったくなかった。 そこで筆者は自己溶解酵素遺伝子の解明を目標として、トランスポゾンTn551を用いて自己溶解変異株を得ることを計画した。その結果、S.aureus RN450よりトランスポゾンTn551を用いて自己溶解変異株RUSAL2を得ることができた。RUSAL2では染色体のSma I断片B上に存在する自己溶解に関連する遺伝子(atlと命名した)にTn551が挿入されていた。RUSAL2は親株と比べ細胞壁分解酵素のプロフィールが変化し、細胞壁の代謝回転速度及び -ラクタム系抗生物質や界面活性剤によって誘発される自己溶解速度が減少していた。 -ラクタム系抗生物質や界面活性剤によって誘発される自己溶解速度が減少していた。 -ラクタム系抗生物質であるメチシリンを加えた時に誘発されるRUSAL2の溶菌速度(濁度の減少速度)は親株RN450と比べずっと遅かった(図1)。 -ラクタム系抗生物質であるメチシリンを加えた時に誘発されるRUSAL2の溶菌速度(濁度の減少速度)は親株RN450と比べずっと遅かった(図1)。 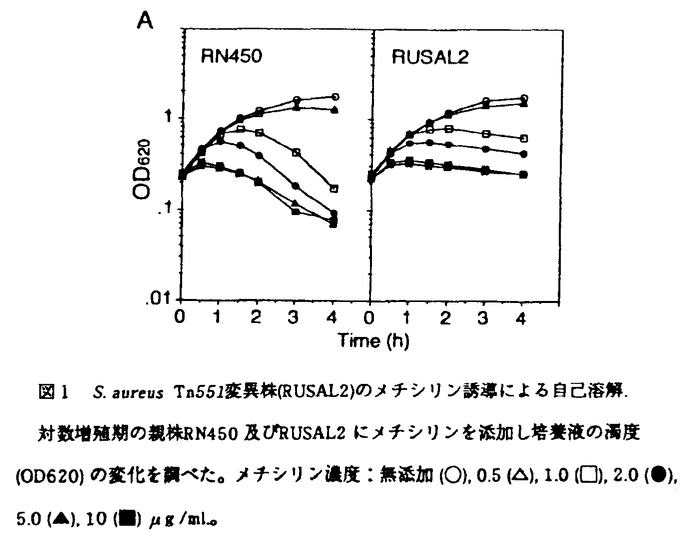 図1 S.aureus Tn551変異株(RUSAL2)のメチシリン誘導による自己溶解.対数増殖期の親株RN450及びRUSAL2にメチシリンを添加し培養液の濁度(OD620)の変化を調べた。メチシリン濃度:無添加(○),0.5(△),1.0(□),2.0(●),5.0(▲),10(■) 図1 S.aureus Tn551変異株(RUSAL2)のメチシリン誘導による自己溶解.対数増殖期の親株RN450及びRUSAL2にメチシリンを添加し培養液の濁度(OD620)の変化を調べた。メチシリン濃度:無添加(○),0.5(△),1.0(□),2.0(●),5.0(▲),10(■) g/ml。 g/ml。 次に、トランスポゾン変異株RUSAL2では細胞壁分解酵素遺伝子が変異している可能性が強かったので、S.aureusの細胞壁分解酵素を精製しその性質と生理学的役割を分析した。細胞クラスターを分散する活性を指標としてS.aureusの培養液に存在する主な溶菌酵素を精製し、51kDaのGLと62kDaのAMを得た。両酵素を分泌しない変異株はクラスターを形成すること、またチバクロンブルーF3GAや抗GL IgGで細胞壁分解酵素活性を阻害するとS.aureusは巨大なクラスターを形成すること、さらにこれらのクラスターはGLとAMを添加することによって分散されることから、両酵素は細胞分裂後の娘細胞の分離に関与していることが明かとなった。 次に、トランスポゾンによる変異を受けているatl遺伝子を解析するためにTn551をプローブとして用いて大腸菌にクローニングした。塩基配列を決定した結果、atlは1256アミノ酸残基からなる分子サイズが137,381Daの塩基性の高い蛋白(ATL)をコードしていた(図2)。ATLには29アミノ酸残基からなるシグナルペプチド様構造が存在した。ATL中央部に約150残基を単位とする3つの繰り返し配列が存在した。S.aureusの培養液より精製されたAMとGLのN末アミノ酸配列を実験的に決定し、DNA配列より求めたアミノ酸配列と比較した。精製したAMのN末配列はATLのAla-199から始まる配列と完全に一致した。一方、精製したGLのN末配列はATLのアミノ酸配列上Ala-776から始まる配列に完全に一致した。従って、2種の異なる細胞壁分解酵素の実験的に求めたN末アミノ酸配列がatl遺伝子上にコードされるATL蛋白のアミノ酸配列上に存在することが判明した。もし、Ala-199からLys-1256までのアミノ酸配列をもつATLポリペプチドがLys-775とAla-776の間で切断されて、2つの分解酵素(AMとGL)になると仮定すると、2つの蛋白の計算上の分子サイズはAla-199からLys-775までの蛋白が62,954Daになり、Ala-776からLys-1256までの蛋白が53,580Daになる。これらの分子サイズはSDS-PAGEによって実験的に求められたAMとGLのそれぞれの分子サイズによく一致することがわかった。精製したAMとGL蛋白を用いて実験的に求めたアミノ酸組成は、ATL上のそれぞれに相当するポリペプチドのアミノ酸配列より計算した組成とよく一致した。 以上より、atlのORFには分解様式の異なる2つの酵素が連結してコードされていることが判明した。2つの酵素はそれぞれ菌体培養液から精製されているので、1つのポリペプチドとして翻訳された蛋白がプロセッシングをうけて2つの酵素として分泌される可能性が考えられた。それを検討するために、スルヒドリルプロテアーゼ阻害剤であるp-hydroxy mercuribenzoic acid存在下で生育した菌体の保有する細胞壁分解酵素プロフィールを調べた。阻害剤が存在することにより51-kDa GL及び62-kDa AMに相当する溶菌バンドが減弱し、対照的に約150kDaのサイズを有する溶菌バンドが増強した。この結果は、1つの150kDa前駆蛋白からプロテアーゼによるプロセッシングを受けて51-kDa GL及び62-kDa AMが生じることを強く示唆した。  図2. S.aureus atl遺伝子がコードするATL蛋白のアミノ酸配列▽:シグナルペプチドの推定切断部位。アンダーライン:3回の繰り返し配列。太文字:精製した蛋白より実験的に求めたN末アミノ酸配列と一致した部分。AMについてはAla-199より、GLについてはAla-776より始まる配列。 図2. S.aureus atl遺伝子がコードするATL蛋白のアミノ酸配列▽:シグナルペプチドの推定切断部位。アンダーライン:3回の繰り返し配列。太文字:精製した蛋白より実験的に求めたN末アミノ酸配列と一致した部分。AMについてはAla-199より、GLについてはAla-776より始まる配列。 ATLは複雑なモジュール構造をとっていた。データベースを利用しATLと他菌種の細胞壁分解酵素とのアミノ酸配列比較を行ったところ、ATLのAMドメインのAla-199より始まるN末部分はBacillus subtilisの産生する細胞壁分解酵素のN末部分と83アミノ酸残基のうちの40%の相同性を示し、またStreptococcus pneumoniaeのEJ-1バクテリオファージのAMのN末部分と163アミノ酸残基のうち24%の相同性を示した。この相同性を示す部分に酵素活性中心が存在すると考えられた。2回の繰り返し構造をとるAMドメインのC末領域は細胞表層成分への結合に関与する可能性が強かった。一方、GLドメインはC末部分に活性中心をもち、N末領域にAMドメインの繰り返しと似た構造をもっていた。GLドメインの構造はAMとは逆の構造をとっているが、この構造の違いや繰り返し配列の相同性の違いは両酵素の細胞表層における認識部位の違いを反映している可能性があると考えられた。ATLが複雑なモジュール構造をとっていることはatl遺伝子の進化の過程で遺伝子融合や遺伝子重複が起きたことを示し非常に興味深い。 トランスポゾン変異株RUSAL2のもつ細胞壁分解酵素の解析結果から、atl遺伝子産物はLiCl細胞抽出液中(細胞壁に非共有結合で結合している蛋白を主に含む)に存在する細胞壁分解活性の8/9を担っていた。また、細胞壁分解活性の種類では、LiCl細胞抽出液中に存在するすべての糖鎖分解活性を担い、さらに少なくても3/4のアミノ基遊離活性(AMあるいはendopeputidase活性)を担っていた。従って、atl遺伝子産物はS.aureusのもつ主要な自己溶解酵素であることが明かとなった。 本研究で得られた知見をまとめる。atl遺伝子はS.aureusに広く保存されていると考えられ、そのコードする蛋白はS.aureusのもつ主要な自己溶解酵素であるとともに、生理的には細胞分裂サイクルの最終段階である細胞分離に関与している。また、細胞壁の代謝回転及び -ラクタム系抗生物質や界面活性剤によって誘発される自己溶解にも働いている。atl遺伝子にはAMドメインとGLドメインを同時にもつ分子サイズ137kDaのATL蛋白がコードされている。ATL蛋白は1つのポリペプチドとして生成された後にプロセッシングを受けて2種の菌体外分泌型の細胞壁分解酵素に変化すると考えられる。 -ラクタム系抗生物質や界面活性剤によって誘発される自己溶解にも働いている。atl遺伝子にはAMドメインとGLドメインを同時にもつ分子サイズ137kDaのATL蛋白がコードされている。ATL蛋白は1つのポリペプチドとして生成された後にプロセッシングを受けて2種の菌体外分泌型の細胞壁分解酵素に変化すると考えられる。 |
| 審査要旨 | | ペプチドグリカンは細菌の細胞壁を構成する物質で菌が正常な形態を保つ役割を果たしている。自己のペプチドグリカンを開裂する酵素は自己溶解酵素(autolysin)と定義され,細胞分裂や娘細胞の分離,また,生存に不都合な状況におかれたときの溶菌や -ラクタム薬によって誘導される溶菌に関与しているとされる。黄色ブドウ球菌(Staphylococcus aureus)はヒトに病原性を示す臨床上重要な菌種であり,その自己溶解酵素についての研究は細菌の生理学上重要な知見を提供することが期待された。 -ラクタム薬によって誘導される溶菌に関与しているとされる。黄色ブドウ球菌(Staphylococcus aureus)はヒトに病原性を示す臨床上重要な菌種であり,その自己溶解酵素についての研究は細菌の生理学上重要な知見を提供することが期待された。 本論文はこのような背景に基づき,S.aureusの自己溶解変異株の取得,細胞分離に働く2種の細胞壁分解酵素の精製,およびその遺伝子のクローニングと構造解析について報告している。 まず,S.aureus RN450株よりトランスポンTn551を用いた挿入失活により自己溶解欠損変異株を得たことを述べている。変異株は親株と比べ細胞壁分解酵素のプロフィールが変化し,細胞壁の代謝回転速度および -ラクタム薬や界面活性剤によって誘発される自己溶解速度が減少していた。Tn551は染色体のSma I断片B上に挿入され,そこに自己溶解に関与する遺伝子が存在すると考えられた。 -ラクタム薬や界面活性剤によって誘発される自己溶解速度が減少していた。Tn551は染色体のSma I断片B上に挿入され,そこに自己溶解に関与する遺伝子が存在すると考えられた。 次に,S.aureusの培養上清より細胞壁分解酵素を精製しその性質と生理学的役割を検討している。細胞クラスターを分散する活性を指標として培養液に存在する主な細胞壁分解酵素を精製し,51kDaのendo- -N-acetylglucosaminidase,さらに62kDaのN-acetylmuramyl-L-alanine amidaseを得た。両酵素を分泌しない株はクラスターを形成すること,またチバクロンプルーF3GAや抗51kDa蛋白IgGで細胞壁分解活性を阻害するとS.aureusは巨大なクラスターを形成すること,さらにこれらのクラスターは両酵素を添加することによって分散されることから両酵素は細胞分裂後の娘細胞の分離に関与していることを明かにした。 -N-acetylglucosaminidase,さらに62kDaのN-acetylmuramyl-L-alanine amidaseを得た。両酵素を分泌しない株はクラスターを形成すること,またチバクロンプルーF3GAや抗51kDa蛋白IgGで細胞壁分解活性を阻害するとS.aureusは巨大なクラスターを形成すること,さらにこれらのクラスターは両酵素を添加することによって分散されることから両酵素は細胞分裂後の娘細胞の分離に関与していることを明かにした。 最後に,トランスポゾンが挿入された遺伝子をTn551をプローブとして用いて,大腸菌にクローニングし,構造解析したことについて述べている。atlと命名された遺伝子は1256アミノ酵残基からなる分子サイズが137,381Daの蛋白(ATL)をコードしていた。ATLにはシグナルペプチド様構造が有在し,中央部に約150残基を単位とする3つの繰り返し配列が存在した。先に精製した2つの蛋白についてN末アミノ酸配列とアミノ酸組成を実験的に決定し,DNA配列より求めたアミノ酸配列と比較した結果,ATLには2つの酵素が直列に連結して存在することが判明した。スルヒドリルプロテアーゼ阻害剤を用いた実験結果から,1つの前駆蛋白がブロセッシングされて両酵素が生じることが強く示唆された。またATLのAla-199より始まるami-daseドメインのN末部分は他の細菌種が産生するamidaseの活性中心を含むN末部分と高いホモロジーを示した。2回の繰り返し構造をとるC末領域は細胞表層成分への結合に関与する可能性が考えられた。一方,Ala-776から始まるendo- -N-acetylglucosaminidaseドメインはN末に繰り返し領域をもち,C末部分に活性中心をもっていた。ATLが全体としてこのように複雑なモジュール構造をとっていることは遺伝子の進化の過程で遺伝子融合や遺伝子重複が起きたことを示唆していた。 -N-acetylglucosaminidaseドメインはN末に繰り返し領域をもち,C末部分に活性中心をもっていた。ATLが全体としてこのように複雑なモジュール構造をとっていることは遺伝子の進化の過程で遺伝子融合や遺伝子重複が起きたことを示唆していた。 以上本論文はS.aureusの自己溶解酵素についてその蛋白と遺伝子を解析し,その蛋白が1つの前駆蛋白として生成された後にプロセッシングを受けて2種の菌体外分泌型の細胞壁分解酵素に変化すると考えられること,さらに生理的には主要な自己溶解酵素であるとともに,細胞分離や細胞壁の代謝回転に関与していることを明らかにしたものであって,学術上寄与するところが少なくない。よって審査員一同は,申請者に博士(農学)の学位を授与してしかるべきものと判断した。 |