| 内容要旨 | |  1アドレナリン受容体はカルシウム動員性ホルモン受容体の1つであり,生体内において血管収縮や筋収縮などの様々な重要な機能を担っている.薬理学的には 1アドレナリン受容体はカルシウム動員性ホルモン受容体の1つであり,生体内において血管収縮や筋収縮などの様々な重要な機能を担っている.薬理学的には 1Aと 1Aと 1Bの2つのサブタイプ受容体に分けられる一方で,近年の遺伝子クローニングにより3つのサブタイプ受容体( 1Bの2つのサブタイプ受容体に分けられる一方で,近年の遺伝子クローニングにより3つのサブタイプ受容体( 1a, 1a, 1b, 1b, 1d)に分けられることが明らかになってきた. 1d)に分けられることが明らかになってきた.  1アドレナリン受容体の細胞内情報伝達機構としては,主としてGqサブタイプのGTP結合蛋白質に共役してホスホリパーゼCを活性化させることにより,イノシトールリン脂質代謝回転と細胞内カルシウム濃度([Ca2+]i)上昇を引き起こす経路が知られている.しかしまた,ある種の臓器(ラット肝臓や大脳皮質など)においては, 1アドレナリン受容体の細胞内情報伝達機構としては,主としてGqサブタイプのGTP結合蛋白質に共役してホスホリパーゼCを活性化させることにより,イノシトールリン脂質代謝回転と細胞内カルシウム濃度([Ca2+]i)上昇を引き起こす経路が知られている.しかしまた,ある種の臓器(ラット肝臓や大脳皮質など)においては, 1アドレナリン受容体を刺激することにより,cAMP産生上昇も引き起こす. 1アドレナリン受容体を刺激することにより,cAMP産生上昇も引き起こす. 1受容体刺激によるcAMP産生上昇のメカニズムは,特に 1受容体刺激によるcAMP産生上昇のメカニズムは,特に 1B受容体を発現させた細胞系で検討されてきたが,現在まではホスホリパーゼC活性化を介した二次的な経路が示唆されてきた.すなわち, 1B受容体を発現させた細胞系で検討されてきたが,現在まではホスホリパーゼC活性化を介した二次的な経路が示唆されてきた.すなわち, 1B受容体を刺激することにより,ホスホリパーゼC活性化を介してプロテインキナーゼC(Cキナーゼ)が活性化され,さらにアデニル酸シクラーゼ活性化に至る伝達経路が考えられてきた. 1B受容体を刺激することにより,ホスホリパーゼC活性化を介してプロテインキナーゼC(Cキナーゼ)が活性化され,さらにアデニル酸シクラーゼ活性化に至る伝達経路が考えられてきた. 本研究においては, 1Bアドレナリン受容体を介したcAMP産生上昇がホスホリパーゼC活性化を介したクロストークによるのか,もしくはホスホリパーゼC系以外の経路,例えば 1Bアドレナリン受容体を介したcAMP産生上昇がホスホリパーゼC活性化を介したクロストークによるのか,もしくはホスホリパーゼC系以外の経路,例えば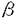 アドレナリン受容体を介したcAMP産生上昇と同様に アドレナリン受容体を介したcAMP産生上昇と同様に 1B受容体がGs蛋白に直接共役することによるのかを,ハムスター 1B受容体がGs蛋白に直接共役することによるのかを,ハムスター 1B受容体を安定発現させたCHO細胞を用いて検討した. 1B受容体を安定発現させたCHO細胞を用いて検討した. CHO細胞に発現された 1B受容体はノルエピネフリン(NE)刺激により,[Ca2+]i上昇とcAMP産生上昇を引き起こし,これらの反応は2つとも 1B受容体はノルエピネフリン(NE)刺激により,[Ca2+]i上昇とcAMP産生上昇を引き起こし,これらの反応は2つとも 1アドレナリン受容体選択的阻害薬であるプラゾシンおよび 1アドレナリン受容体選択的阻害薬であるプラゾシンおよび 1B受容体選択的アルキル化剤であるクロロエチルクロニジン(CEC)によって阻害された.ホスホリパーゼC阻害薬であるU-73,122は[Ca2+]i上昇反応を完全に抑制するのに対して,cAMP産生上昇に対しては全く影響しなかった.Ca2+イオノフォア(A23187)は[Ca2+]i上昇を起こすが,cAMP基礎産生量およびNE刺激によるcAMP反応に対しては効果を示さなかった.インドメサシンもcAMP産生上昇に対しては影響せず, 1B受容体選択的アルキル化剤であるクロロエチルクロニジン(CEC)によって阻害された.ホスホリパーゼC阻害薬であるU-73,122は[Ca2+]i上昇反応を完全に抑制するのに対して,cAMP産生上昇に対しては全く影響しなかった.Ca2+イオノフォア(A23187)は[Ca2+]i上昇を起こすが,cAMP基礎産生量およびNE刺激によるcAMP反応に対しては効果を示さなかった.インドメサシンもcAMP産生上昇に対しては影響せず, 1B受容体によるcAMP産生上昇においてプロスタグランジン合成系の関与は示唆されなかった.また,これまでの報告と異なり,Cキナーゼ阻害薬(H-7およびスタウロスポリン)はcAMP産生上昇に対して影響を与えなかった.Cキナーゼを活性化するホルボールエステルPMA(phorbol-12-myristate-13-acetate)はNE刺激による[Ca2+]i上昇およびcAMP産生上昇を有意に抑制した.また,百日咳毒素はNE刺激による[Ca2+]i上昇およびcAMP産生上昇を阻害しなかったため,百日咳毒素感受性G蛋白の関与は可能性が少ないと考えられた. 1B受容体によるcAMP産生上昇においてプロスタグランジン合成系の関与は示唆されなかった.また,これまでの報告と異なり,Cキナーゼ阻害薬(H-7およびスタウロスポリン)はcAMP産生上昇に対して影響を与えなかった.Cキナーゼを活性化するホルボールエステルPMA(phorbol-12-myristate-13-acetate)はNE刺激による[Ca2+]i上昇およびcAMP産生上昇を有意に抑制した.また,百日咳毒素はNE刺激による[Ca2+]i上昇およびcAMP産生上昇を阻害しなかったため,百日咳毒素感受性G蛋白の関与は可能性が少ないと考えられた. 1B受容体安定発現CHO細胞はコレラ毒素によりcAMP基礎産生量が50倍増加すること,抗Gs蛋白 1B受容体安定発現CHO細胞はコレラ毒素によりcAMP基礎産生量が50倍増加すること,抗Gs蛋白 サブユニット抗体によるウエスタンブロッティングにより45kDaと42kDaの サブユニット抗体によるウエスタンブロッティングにより45kDaと42kDaの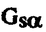 蛋白が検出されることから,同細胞はアデニル酸シクラーゼ系と直接共役するGs蛋白を有することが示された.以上の結果から, 蛋白が検出されることから,同細胞はアデニル酸シクラーゼ系と直接共役するGs蛋白を有することが示された.以上の結果から, 1B受容体によるcAMP産生上昇は,ホスホリパーゼC系以外の経路により直接引き起こされる可能性が考えられ,その経路には百日咳毒素非感受性G蛋白の関与が考えられた.そこで,細胞膜を用いてアデニル酸シクラーゼ活性の検討を行ったところ,NE刺激によりアデニル酸シクラーゼが活性化され,その活性上昇反応は,Gs蛋白 1B受容体によるcAMP産生上昇は,ホスホリパーゼC系以外の経路により直接引き起こされる可能性が考えられ,その経路には百日咳毒素非感受性G蛋白の関与が考えられた.そこで,細胞膜を用いてアデニル酸シクラーゼ活性の検討を行ったところ,NE刺激によりアデニル酸シクラーゼが活性化され,その活性上昇反応は,Gs蛋白 サブユニットのC末端に対するペプチド抗体の存在でコントロールに比して78%抑制される結果が得られた.さらに,アルキル化剤フェノキシベンザミンによる サブユニットのC末端に対するペプチド抗体の存在でコントロールに比して78%抑制される結果が得られた.さらに,アルキル化剤フェノキシベンザミンによる 1B受容体不活性化実験から,NE刺激による[Ca2+]i上昇反応は受容体占拠率に対してhyperbolicな関係を示し,[Ca2+]i反応に関与しない余分な受容体(余剰受容体)が豊富に存在するのに対して,cAMP産生上昇反応は受容体占拠率に対して直線的関係を示し,cAMP反応が[Ca2+]i反応とは独立して起こる可能性がさらに示唆された. 1B受容体不活性化実験から,NE刺激による[Ca2+]i上昇反応は受容体占拠率に対してhyperbolicな関係を示し,[Ca2+]i反応に関与しない余分な受容体(余剰受容体)が豊富に存在するのに対して,cAMP産生上昇反応は受容体占拠率に対して直線的関係を示し,cAMP反応が[Ca2+]i反応とは独立して起こる可能性がさらに示唆された. これらの実験事実により, 1Bアドレナリン受容体がホスホリパーゼC系とは独立してGs蛋白に直接共役し,アデニル酸シクラーゼを活性化してcAMP産生上昇をもたらす経路の存在が初めて明らかになった.本研究の結果は,Gq共役型受容体である 1Bアドレナリン受容体がホスホリパーゼC系とは独立してGs蛋白に直接共役し,アデニル酸シクラーゼを活性化してcAMP産生上昇をもたらす経路の存在が初めて明らかになった.本研究の結果は,Gq共役型受容体である 1B受容体が,生体内においてもホスホリパーゼC系以外にGs/アデニル酸シクラーゼ系に直接共役する可能性を示唆するものと考えられた. 1B受容体が,生体内においてもホスホリパーゼC系以外にGs/アデニル酸シクラーゼ系に直接共役する可能性を示唆するものと考えられた. |
| 審査要旨 | | 本研究は,カルシウム動員性ホルモン受容体の1つである 1Bアドレナリン受容体がホスホリパーゼC活性化以外に引き起こすcAMP産生上昇のメカニズムを明らかにするため,ハムスター 1Bアドレナリン受容体がホスホリパーゼC活性化以外に引き起こすcAMP産生上昇のメカニズムを明らかにするため,ハムスター 1Bアドレナリン受容体を安定発現させたCHO細胞の系を用いて, 1Bアドレナリン受容体を安定発現させたCHO細胞の系を用いて, 1Bアドレナリン受容体の細胞内情報伝達機構の解析を試みたものであり,下記の結果を得ている. 1Bアドレナリン受容体の細胞内情報伝達機構の解析を試みたものであり,下記の結果を得ている. 1.ハムスター 1Bアドレナリン受容体安定発現CHO細胞において, 1Bアドレナリン受容体安定発現CHO細胞において, 1B受容体特異的なcAMP産生上昇が認められ,このcAMP反応はホスホリパーゼC阻害薬U-73,122およびCキナーゼ阻害薬(H-7とスタウロスポリン)によって影響を受けなかった.従って,これまでの報告と異なり, 1B受容体特異的なcAMP産生上昇が認められ,このcAMP反応はホスホリパーゼC阻害薬U-73,122およびCキナーゼ阻害薬(H-7とスタウロスポリン)によって影響を受けなかった.従って,これまでの報告と異なり, 1B受容体を介するcAMP産生上昇はホスホリパーゼCおよびCキナーゼ活性化を介するクロストークによるものではないことが示された. 1B受容体を介するcAMP産生上昇はホスホリパーゼCおよびCキナーゼ活性化を介するクロストークによるものではないことが示された. 2. 1B受容体を介するcAMP反応は百日咳毒素により影響を受けなかったため,百日咳毒素感受性G蛋白が 1B受容体を介するcAMP反応は百日咳毒素により影響を受けなかったため,百日咳毒素感受性G蛋白が 1B受容体を介するcAMP反応に関与しないことが示された. 1B受容体を介するcAMP反応に関与しないことが示された. 3. 1B受容体安定発現CHO細胞はコレラ毒素によりcAMP基礎産生量が50倍増加し,抗Gs蛋白 1B受容体安定発現CHO細胞はコレラ毒素によりcAMP基礎産生量が50倍増加し,抗Gs蛋白 サブユニット抗体によるウエスタンブロッティングにより45kDaと42kDaの サブユニット抗体によるウエスタンブロッティングにより45kDaと42kDaの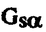 蛋白がCHO細胞に検出されることから, 蛋白がCHO細胞に検出されることから, 1B受容体安定発現CHO細胞はアデニル酸シクラーゼ系と直接共役するGs蛋白を有することが示された. 1B受容体安定発現CHO細胞はアデニル酸シクラーゼ系と直接共役するGs蛋白を有することが示された. 4. 1B受容体安定発現CHO細胞の細胞膜を用いたアデニル酸シクラーゼ活性の検討では,NE刺激により活性上昇が認められ,その活性上昇反応は,抗 1B受容体安定発現CHO細胞の細胞膜を用いたアデニル酸シクラーゼ活性の検討では,NE刺激により活性上昇が認められ,その活性上昇反応は,抗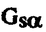 抗体により77.6±6.3%が抑制された.従って, 抗体により77.6±6.3%が抑制された.従って, 1B受容体がホスホリパーゼC系とは独立してGS/アデニル酸シクラーゼ系に直接共役することが明らかになった. 1B受容体がホスホリパーゼC系とは独立してGS/アデニル酸シクラーゼ系に直接共役することが明らかになった. 5.アルキル化剤フェノキシベンザミンによる 1B受容体不活性化実験から, 1B受容体不活性化実験から, 1B受容体安定発現CHO細胞におけるNE刺激による[Ca2+]i上昇反応は受容体占拠率に対してhyperbolicな関係を示し,[Ca2+]i反応に関与しない余分な受容体(余剰受容体)が豊富に存在するのに対して,cAMP産生上昇反応は受容体占拠率に対して直線的関係を示し,cAMP反応が[Ca2+]i反応とは独立して起こる可能性がさらに示唆された. 1B受容体安定発現CHO細胞におけるNE刺激による[Ca2+]i上昇反応は受容体占拠率に対してhyperbolicな関係を示し,[Ca2+]i反応に関与しない余分な受容体(余剰受容体)が豊富に存在するのに対して,cAMP産生上昇反応は受容体占拠率に対して直線的関係を示し,cAMP反応が[Ca2+]i反応とは独立して起こる可能性がさらに示唆された. 以上,本論文はハムスター 1Bアドレナリン受容体安定発現CHO細胞において, 1Bアドレナリン受容体安定発現CHO細胞において, 1Bアドレナリン受容体の細胞内情報伝達機構の解析から, 1Bアドレナリン受容体の細胞内情報伝達機構の解析から, 1B受容体がホスホリパーゼC系とは独立してGs/アデニル酸シクラーゼ系に直接共役することを初めて明らかにした.本研究は,生体内において多様な生理的機能を担う 1B受容体がホスホリパーゼC系とは独立してGs/アデニル酸シクラーゼ系に直接共役することを初めて明らかにした.本研究は,生体内において多様な生理的機能を担う 1アドレナリン受容体の細胞内情報伝達機構を解明する上で重要な貢献をなすと考えられ,学位の授与に値するものと考えられる. 1アドレナリン受容体の細胞内情報伝達機構を解明する上で重要な貢献をなすと考えられ,学位の授与に値するものと考えられる. |