B型肝炎をはじめとして、肝炎においては肝細胞上の抗原抗体反応に伴う肝細胞の障害、炎症細胞の肝細胞への浸潤といった生体防御系による肝細胞に対する攻撃が大きな増悪要因となっていることは広く知られている。しかし、医薬品として臨床の場に供せられている薬剤の中で、これらの攻撃因子に対し明確な細胞保護作用を有するものはほとんどない。そこで、新規肝疾患治療薬として、生体防御系の攻撃に対する肝細胞の保護作用を有する化合物を見いだすために本研究を開始した。 用いるスクリーニング系としては、肝炎の病態に於いて多く見られるマクロファージ、好中球等の炎症性細胞による細胞浸潤過程を反映するモデルと考えられるラットガラクトサミン肝障害モデルと、免疫系による細胞侵襲過程をよく反映するモデルと考えられるラット補体依存性肝障害モデルとの2つの系を選択した。ガラクトサミン肝障害モデルに関しては、D-ガラクトサミンによる障害惹起1時間前に薬物を300mg/kg経口投与し、24時間後のGPT上昇に対する抑制率を算出し、肝障害に対する改善効果の指標とした。補体依存性肝障害モデルに関しては、抗ラット肝細胞膜モノクローナル抗体による障害惹起1時間前に薬物を30mg/kg腹腔内投与し1時間後のGPT上昇に対する抑制率を改善効果の指標とした。なお現在報告されている肝疾患治療薬の中で、補体依存性肝障害モデルに対し抑制活性を示す化合物は存在しない。 (1) 3-オキソ類の合成と肝障害抑制作用 リード化合物を探索するに当たり、肝保護作用を持つと報告されている化合物について過去の文献、特許を調査した結果、マロチラート1、ピプロゾリン2に着目した。この2つの化合物は低分子化合物で誘導体合成が容易であり、共にアルコキシカルボニル基と、硫黄を含むヘテロ環が2重結合を介して結合するという共通の部分構造を有している。両化合物は、共にガラクトサミン肝障害モデルに関し有効性を示すことが報告されているが、補体依存性肝障害モデルについての我々の評価結果ではほとんど無効であった。1のジチオール環は代謝的に不安定であるとの報告があるため、チアゾリン環を有する2をリード化合物とし、これを構造変換し補体依存性肝障害モデルに有効な化合物を見いだすことを第一の目標とした。ピプロゾリン2のエキソメチレン部の構造は、すでに図に示すようなZ体と決定されているので、N-エチル基とエキソメチレン部を閉環させ配位を固定した4を考え、2位(R2a,R2b)に多種の置換基を導入し活性を検討した。 合成はチオラククム5を主原料とし、既知の4-オキソチアゾールの合成法を利用し行った。評価の結果、2位にフェニル基とメトキシ基を有する化合物6が補体依存性肝障害モデルに対し強い抑制作用を示した。しかし6をはじめとして、これらの誘導体のガラクトサミン肝障害モデルに対する活性はかなり減弱していた(Fig 1)。  Fig.1 3-オキソ類の合成と肝障害抑制作用(2) チアゾール類の合成と肝障害抑制作用 Fig.1 3-オキソ類の合成と肝障害抑制作用(2) チアゾール類の合成と肝障害抑制作用 以上の検討により、補体依存性肝障害モデルに有効性を示す化合物6を見いだすことができた。そこで、このリングシステムを基にガラクトサミン肝障害モデルにも有効な化合物を見いだすことを目標とし、次に化合物6にマロチラート1と同様の共役系を組み込んだ化合物(一般式7)を考え、R2、R3に多種の置換基を導入し活性を検討した。 合成はチオラクタム5を主原料とし、主として既知のチアゾール合成法を利用して行った(Method A)。また8位のエトキシカルボニル基が、求核試薬に対して不反応であることを見いだしたため、別途法による合成(Method B)やチアゾール環上の置換基の変換が容易に可能となった。評価の結果、無置換体7a、3-メチルカルバモイル体7bが両系に対し抑制作用を有することを見いだした。マウスを用いた急性毒性試験において7aでは毒性が観察されたが、7bでは3g/kg p.o.においても死亡例は観察されなかった。また7bの周辺化合物の構造活性相関の検討により、チアゾール環とカルバモイル基が直結する共役系が障害抑制作用の発現に重要であることが示唆された(Fig 2)。  Fig.2 チアゾール類の合成と肝障害仰制作用(3) 3-エキソメチレン類の合成と肝障害抑制作用 Fig.2 チアゾール類の合成と肝障害仰制作用(3) 3-エキソメチレン類の合成と肝障害抑制作用 2章において共役系の重要性が示唆されたため、7bをさらに構造変換し、チアゾール環とカルバモイル基の間にさらにsp2炭素をはさんだエキソニ重結合を有する化合物8を考えた。合成を試みたところ、アミド化の結果エンド体10のみ得られ、目的とするエキソ体は得られなかった。そこで、縮合環に歪みを加えることでエキソ体の生成比を増大させることを目的に、5員環チオラクタム5aを出発物質として5-5のリングシステムで同様に合成を試みたところ、単一のエキソのアミド化体11aが高収率で得られた。エキソメチレン部の配位についてはE体、Z体の2つの可能性が考えられるが、1H-NMRでのNOE測定によりE体(図に記述通り)をとっているものと推定した。11aはラット補体依存性肝障害モデルに対しても、ガラクトサミン肝障害モデルに対しても高い有効性を示したため、一般式11に示すこの周辺化合物の合成を11aと同様の方法で行い、肝障害抑制作用を検討した。評価の結果、両モデルに対し高い障害抑制活性を有する11bを見いだした(Fig 3)。  Fig.3 3-エキソメチレン類の合成と肝障害抑制作用(4) 5,6-デヒドロ体の合成と肝障害抑制作用 Fig.3 3-エキソメチレン類の合成と肝障害抑制作用(4) 5,6-デヒドロ体の合成と肝障害抑制作用 前章で得た11bのエキソメチレン構造の安定性について検討したところ、11bをpH1の水溶液で処理すると瞬時にエンドタイプの異性体12bに異性化することがわかり、経口投与した際に胃中で異性化されやすいことが予想された。12bの補体依存性肝障害モデルに対する抑制活性は弱い(37%)ものであることより、エキソメチレン構造が活性発現に大きく関与していることが示唆されると共に、酸性条件下にエキソ構造を維持する分子設計が必要となった(Fig 4)。  Fig.4 11bの酸性条件下における異性化 Fig.4 11bの酸性条件下における異性化 まず異性化が不可能となるように2位にメチル基を2つ導入した化合物13を合成したが、補体依存性肝障害モデルに対する抑制活性は低下した。次に、異性化の1段階目と推定されるプロトン化を防ぐことができれば異性化を遅くすることができるのではないかと考え、窒素原子の非共有電子対を芳香化によりピロール環上に非局在化させた化合物、すなわち5,6位を脱水素した一般式14に示す化合物をデザインした。前章で得た11をDDQ(2,3-dichloro-5,6-dicyanobenzoquinone)を用い、E配位のエキソメチレン構造を保持したままで脱水素することにより、14に示す誘導体を合成し、肝障害抑制作用を検討した。その結果、両系に強い抑制作用を有する14aを見いだしDV-7021と名付けた。この14aは予想通りpH1の水溶液で処理してもエンド体への異性化が遅く、主薬埋、安定性共にすぐれた性質を持つ化合物と考えられた(Fig 5)。  Fig.5 5,6-デヒドロ類の合成と肝障害抑制作用結論 Fig.5 5,6-デヒドロ類の合成と肝障害抑制作用結論 筆者はラット補体依存性肝障害モデル、ラットガラクトサミン肝障害モデルに対し経口投与で有効性を示す肝庇護剤の探索を企画し、双環性チアゾリン誘導体の合成と構造活性相関を検討した。本研究に基づき、補体依存性肝障害モデルに有効な6、ガラクトサミン肝障害モデルにも有効性を示す7b、両系にさらに高活性を示すエキソメチレンタイプの11bへと構造変換を行った。そして11bの異性化の問題を解決し、優れた作用を有するDV-7021(14a)を見いだした。(Fig 6) 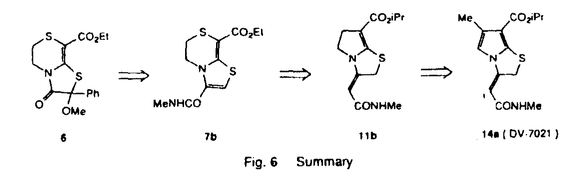 Fig.6 Summary Fig.6 Summary |