学位論文要旨
| No | 212517 | |
| 著者(漢字) | 白瀧,博通 | |
| 著者(英字) | Shirataki,Hiromichi | |
| 著者(カナ) | シラタキ,ヒロミチ | |
| 標題(和) | Rab3A低分子量GTP結合蛋白質の標的蛋白質の精製、クローニングと生化学的性状 | |
| 標題(洋) | Purification,cloning,and characterization of a putative target protein for Rab3A small GTP-binding protein | |
| 報告番号 | 212517 | |
| 報告番号 | 乙12517 | |
| 学位授与日 | 1995.10.25 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第12517号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | Ras類似低分子量GTP結合蛋白質(低分子量G蛋白質)は現在約50種類以上見出されており、いくつかのサブファミリーに分かれている。このうち、Rabファミリーは細胞内小胞輸送に関与していることが明らかになっている。このRabファミリーの中で、Rab3Aはシナプスや唾液腺、膵臓の内・外分泌腺などの外界刺激に反応して分泌(regulated secretion)を行なう組織に特異的に分布している。このことから、Rab3Aはregulated secretionを行なう細胞の細胞内小胞輸送を制御していると考えられている。特にシナプスでは、Rab3Aは、シナプス小胞に局在しており、Rab3Aノックアウトマウスの実験結果からシナプス小胞のプレシナプス膜へのドッキングを制御していると考えられている。 Rab3AにはGDP結合型の不活性型とGTP結合型の活性型が存在し、活性型のGTP結合型Rab3Aがその標的蛋白質に結合してその機能を遂行すると考えられている。そこで、本研究ではRab3Aの標的蛋白質を精製してそのcDNAをクローニングし、一次構造を決定してRabphilin-3Aと命名した。さらに、膜貫通領域を持たないRabphilin-3Aがシナプス小胞に局在していることから、Rabphilin-3Aのシナプス小胞への結合様式についても解析した。 Lipid-modified Rab3Aとlipid-unmodified Rab3Aは、Rab3AをoverexpressionしたSpodoptera frugiperda cells(Sf9細胞)と大腸菌からそれぞれ精製した。c-Ki-RasとRhoA、Rap1Bは、それぞれの蛋白質をoverexpressionしたSf9細胞からそれぞれ精製した。Rab11は、Rab11をoverexpressionした大腸菌から精製した。Rab GDIは、ウシ大脳より精製した。シナプス小胞は、ラット大脳より精製した。 GTP Rabphilin-3Aと125I-標識GTP Rabphilin-3Aの部分アミノ酸配列に相当するオリゴヌクレオチドプローブを用いてウシ大脳cDNAライブラリーをスクリーニングした。それにより得られたcDNAをシークエンスしてRabphilin-3Aの全アミノ酸配列を決定した。 Rabphilin-3Aの部分アミノ酸配列に相当する18個のアミノ酸からなる合成ペプタイドをウサギに免疫し、得られた抗血清を抗原-アフィニティカラムにて精製した。 GST(glutathione S-transferase)-Rabphilin-3Aは、Rabphilin-3AcDNAを組込んだ発現ベクターpGEX-2Tをトランスフォームさせた大腸菌より精製した。recombinant Rabphilin-3Aは、Rabphilin-3AcDNAを組込んだ発現ベクターpAcYM1をトランスフェクトしたバキュロウイルスを感染させたSf9細胞より精製した。 ラットの各組織をSDS-PAGEして抗Rabphilin-3A抗体を用いてイムノブロットを行った。また、Rabphilin-3AcDNA全長をプローブとして、ラットの各組織についてノーザンブロットを行った。 GST-Rabphilin-3Aを、GTP 種々の濃度のNaClで処理したシナプス小胞を、超遠心にてシナプス小胞画分とNaCl可溶画分に分離した。次に、その得られたおのおのの分画をSDS-PAGEして抗Rabphilin-3A抗体と抗Rab3A抗体、抗synaptophysin抗体を用いてウエスタンブロットを行なった。 シナプス小胞を1MNaClで処理し、ほとんどのRabphilin-3Aを可溶化してRabphilin-3Aを欠如したシナプス小胞を調製した。 Rabphilin-3Aを欠如したシナプス小胞をGDPと反応させて内在性Rab3AをGDP結合型に変換後、RabGDIを作用させて内在性Rab3Aをシナプス小胞から引き抜いてRab3Aを欠如したシナプス小胞を調製した。 Rabphilin-3Aを欠如したシナプス小胞にGTP 種々の濃度のrecombinant Rabphilin-3Aと反応させたシナプス小胞をシュークロースベッド上に乗せて超遠心を行ない、シナプス小胞に結合したRabphilin-3Aと遊離のRabphilin-3Aを分離した。次に、シナプス小胞画分をSDS-PAGEして抗Rabphilin-3A抗体を用いてウエスタンブロットを行ないシナプス小胞に結合したRabphilin-3Aを定量した。 Rabphilin-3Aを欠如したシナプス小胞をトリプシン処理し、処理後トリプシン阻害剤とプロテアーゼ阻害剤を加えて反応を停止した。反応停止後、トリプシン処理したシナプス小胞は残存トリプシンを除くために再度超遠心を行い調整した。 種々の濃度のCa2+存在下で、NaCl処理によるRabphilin-3Aのシナプス小胞からの解離とrecombinant Rabphilin-3Aのシナプス小胞への結合を検討した。 ウシ大脳膜コール酸可溶性画分と125I-標識GTP Rabphilin-3Aはウシ大脳膜コール酸可溶性画分よりQセファロースカラムクロマトグラフィー、モノQカラムクロマトグラフィー、ハイドロキシアパタイトクロマトグラフィー、ショ糖密度勾配遠心分離法を組み合わせて高度に精製した。さらに、そのアクティブフラクションをPVDF膜に転写後、Rabphilin-3Aに相当するバンドを切り出してRabphilin-3Aを精製した。 Rabphilin-3AはSDS-PAGE上分子量約85kDaで、サブユニット構造をもたない単一のポリペプチドであった。Rabphilin-3Aは、翻訳後修飾に関係なくGTP結合型Rab3Aに結合してGDP結合型Rab3Aにはほとんど結合しなかった。また、c-Ki-RasとRhoA、Rap1B、Rab1lにはGTP結合型、GDP結合型ともに結合しなかった。 Rabphilin-3Aは704個のアミノ酸から成り、大部分が親水性で膜貫通領域を有しなかった。アミノ酸組成から計算した分子量は77,976であった。また、Rabphilin-3Aは既知の蛋白質ではなく全く新しい蛋白質であった。さらに、Rabphilin-3Aには、CキナーゼやsynaptotagminのC2領域と相同性の高い配列がC末端側に2回繰り返して存在していた。 イムノブロットとノーザンブロットの結果から、Rabphilin-3Aはラット大脳にのみ存在していた。 Rabphilin-3AはNaCl濃度依存性にシナプス小胞から解離し、1MNaClでほとんどのRabphilin-3Aはシナプス小胞から解離した。しかし、Rab3Aとsynaptophysinはシナプス小胞からは解離しなかった。 Rabphilin-3Aを欠如したシナプス小胞へのrecombinant Rabphilin-3Aの結合は、Rabphilin-3A濃度依存性であり、飽和結合であった。half maximal bindingは50nMで、シナプス小胞1個当たり約5±1分子のRabphilin-3Aが結合した。しかし、recombinant Rabphilin-3Aは赤血球ゴースト膜には結合しなかった。また、このRabphilin-3Aのシナプス小胞への特異的結合はシナプス小胞をトリプシン処理することで消失した。 recombinant Rabphilin-3Aは、Rab3Aを欠如したシナプス小胞やRab3Aを過剰量結合したシナプス小胞にも同様に結合した。その結合はRabphilin-3A濃度依存性であり、飽和結合であった。half maximal bindingは50nMで、シナプス小胞1個当たり約5±1分子のRabphilin-3Aが結合した。 Ca2+存在下でも、NaCl処理によりRabphilin-3Aはシナプス小胞から解離した。しかし、約10%のRabphilin-3Aは2MNaCl処理でもシナプス小胞から解離しなかった。また、Rabphilin-3Aのシナプス小胞への特異的結合はCa2+によって影響を受けなかった。 Rab3Aは、細胞内小胞輸送、特に神経伝達物質の放出反応において重要な役割を果たす低分子量G蛋白質と考えられているが、その活性制御機構や作用機構の詳細はいまだ不明でる。本研究では、ウシ大脳膜画分よりRab3Aの標的蛋白質(Rabphilin-3A)を精製してその性状を解析し、さらにそのcDNAを単離して全アミノ酸配列を決定した。Rabphilin-3Aは、774個のアミノ酸からなる予想分子量77,596の蛋白質で、GTP結合型Rab3Aにのみ結合してGDP結合型Rab3Aにはほとんど結合しなかった。Rabphilin-3Aには、CキナーゼやsynaptotagminのC2領域と相同性の高い配列がC末端側に2回繰り返して存在していた。Cキナーゼやsynaptotagminは、そのC2領域を介してCa2+依存性にリン脂質と結合することが知られている。実際、Rabphilin-3AはC2領域を介してCa2+依存性にリン脂質と結合することが明らかになっており、Rabphilin-3AはCa2+依存性にリン脂質と結合し、シナプスにおいてCa2+センサーとして機能している可能性がある。イムノブロットとノーザンブロットの結果から、Rabphilin-3Aは大脳にのみ存在していた。ところで、Rab3Aは大脳以外に膵臓や唾液腺にも存在していることから、膵臓や唾液腺にはRabphilin-3Aのアイソフォームが存在している可能性がある。 最近、膜貫通領域を持たないRabphilin-3Aが、シナプス小胞に局在していることが明らかになっている。しかし、Rabphilin-3Aがシナプス小胞に局在する機構については不明である。そこで、膜貫通領域を持たないRabphilin-3Aがシナプス小胞に局在する機構について解析した。Rabphilin-3AはNaCl濃度依存性にシナプス小胞から解離し、1MNaClでほとんどのRabphilin-3Aはシナプス小胞から解離した。Rabphilin-3Aは濃度依存性にRabphilin-3Aを欠如したシナプス小胞に結合し、その結合は飽和結合であった。また、このRabphilin-3Aのシナプス小胞への特異的結合はシナプス小胞をトリプシン処理することで消失したが、Rab3Aによって影響は受けなかった。さらに、NaCl処理によるRabphilin-3Aのシナプス小胞からの解離やRabphilin-3Aのシナプス小胞への特異的結合はCa2+によって影響を受けなかった。このことから、Rabphilin-3Aは、少なくともRab3A以外のシナプス小胞上の蛋白質分子(アンカーリング蛋白質)を介してシナプス小胞に結合していると考えられる。今後、このRabphilin-3Aのアンカーリング蛋白質を同定して精製し、神経伝達物質の放出反応におけるRab3AとRabphilin-3Aの作用機構と活性化機構を明らかにしていきたいと考えている。 | |
| 審査要旨 | 本研究は細胞内小胞輸送、特に神経伝達物質の放出反応に関与している低分子量GTP結合蛋白質(G蛋白質)Rab3Aの標的蛋白質の精製とそのcDNAのクローニングを試み、さらに、その生化学的性状を解析したものであり、下記の結果を得ている。 1.cross-link assay法を用いて、ウシ大脳膜コール酸可溶性画分においてGTP 2.Rab3A標的蛋白質を、cross-link assay法を用いてウシ大脳膜コール酸可溶性画分よりQセファロースカラムクロマトグラフィー、モノQカラムクロマトグラフィー、ハイドロキシアパタイトカラムクロマトグラフィー、ショ糖密度勾配遠心法を組み合わせて高度に精製した。この高度に精製したRab3A標的蛋白質は、GTP 3.この高度に精製したRab3A標的蛋白質をPVDF膜に転写後、Rab3A標的蛋白質に相当するバンドを切り出してRab3A標的蛋白質を精製した。さらに、精製したRab3A標的蛋白質から得られた部分アミノ酸配列をもとにオリゴヌクレオタイドプローブを作成し、ウシ大脳cDNAライブラリーからRab3A標的蛋白質のcDNAをクローニングした。 4.Rab3A標的蛋白質は704個のアミノ酸からなり、大部分が親水性で膜貫通領域を有していなかった。アミノ酸組成から計算した分子量は77,976であった。また、Rab3A標的蛋白質は既知の蛋白質ではなく全く新しい蛋白質であり、Rabphilin-3Aと命名された。さらに、Rabphilin-3Aには、CキナーゼのC2領域と相同性の高い配列がC末端側に2個繰り返して存在していることが示された。CキナーゼはC2領域を介してCa2+とリン脂質に結合することから、Rabphilin-3AもCキナーゼと同様にCa2+とリン脂質に結合する可能性が示唆された。 5.イムノブロットとノーザンブロットの結果から、Rabphilin-3Aはラット大脳にのみ存在していることが示された。 6.免疫組織学的実験から、Rabphilin-3Aはシナプス小胞にのみ存在していることが明らかになっているが、シナプス小胞を1MNaClで処理することでほとんどのRabphilin-3Aはシナプス小胞から解離することが示された。さらに、1MNaCl処理によりRabphilin-3Aを欠如させたシナプス小胞へのrecombinant Rabphilin-3Aの結合は、Rabphilin-3A濃度依存性であり飽和結合であること、そのhalf maximal bindingは50nMで、シナプス小胞1個当たり約5±1分子のRabphilin-3Aが結合することが示された。また、Rabphilin-3Aはトリプシン処理したシナプス小胞や赤血球膜ゴーストには結合しないことから、Rabphilin-3Aはシナプス小胞に少なくとも蛋白分子を介して特異的に結合していることが示された。 7.このRabphilin-3Aのシナプス小胞への特異的結合は、Rab3AやCa2+によって影響を受けないことが示された。 以上、本論文は神経伝達物質の放出反応に関与している低分子量G蛋白質Rab3Aの標的蛋白質(Rabphilin-3A)の精製とそのcDNAのクローニングを行い、さらに、Rabphilin-3Aの生化学的性状についても明らかにした。本研究は、世界で最初に低分子量G蛋白質の標的蛋白質を見出したものであり、低分子量G蛋白質の作用機構や活性化機構の解明に重要な貢献をなすと考えられる。また、神経伝達物質の放出反応の分子メカニズムを解明する上でも重要な貢献をなすと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50672 |
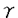 S結合型のlipid-unmodified Rab3Aを125I-Bolton-Hunter試薬にて標識し、disuccinimidyl suberate(DSS)存在下で各サンプルと30℃、30分間インキュベーションさせ、SDS-PAGE後オートラジオグラフィーを行なった。
S結合型のlipid-unmodified Rab3Aを125I-Bolton-Hunter試薬にて標識し、disuccinimidyl suberate(DSS)存在下で各サンプルと30℃、30分間インキュベーションさせ、SDS-PAGE後オートラジオグラフィーを行なった。