消化管粘膜は、細胞更新のきわめて速い組織である。上皮細胞はたえず増殖分裂を操り返し、数日内に管腔側にはげ落ち更新されている。胃粘膜でも腸粘膜でも細胞増殖は粘膜の特定の部位に存在する増殖細胞(幹細胞)から増殖・分化する。幹細胞は常に増殖を繰り返し様々な細胞に分化する。消化管の細胞は増殖しながら分化する動的で独特な細胞であるといえる。この上皮細胞の増殖・分化には多くの増殖因子がオートクリン・パラクリン因子として関与していることが明らかになってきた。一般に消化管上皮細胞の増殖にはTGF- ,EGF,HGFなどが、間質細胞の増殖にはbFGF,TGF- ,EGF,HGFなどが、間質細胞の増殖にはbFGF,TGF- ,EGFなどが関与することが知られている。これらの増殖因子は潰瘍性病変などの粘膜欠損の修復過程で重要な役割を果たしていることが明らかになってきた。これら増殖因子の作用や作用機序を明らかにすることは潰瘍性病変などの病態生理の理解、さらには治療法の確立において重要であると考えられる。 ,EGFなどが関与することが知られている。これらの増殖因子は潰瘍性病変などの粘膜欠損の修復過程で重要な役割を果たしていることが明らかになってきた。これら増殖因子の作用や作用機序を明らかにすることは潰瘍性病変などの病態生理の理解、さらには治療法の確立において重要であると考えられる。 トコレチネート(TR)はレチノイン酸とトコフェロールをエステル結合して得られた化合物である。この新規化合物は線維芽細胞などの細胞系で増殖促進作用を示し、また血管新生促進作用など多彩な薬理活性をもつことが知られている。実際ラット実験消化性潰瘍でその修復を促進することが確認されている。TRは経口的に投与されると消化管でまったく分解・吸収されずに便中にそのままの形で回収される。このことはTRが小腸、あるいは大腸の粘膜へそのままの形で到達することを意味している。従ってもし小腸や大腸の粘膜の上皮細胞に対して増殖促進作用をもつならば、胃潰瘍治癒促進効果と同様に、クローン病や潰瘍性大腸炎などの大腸粘膜病変の治癒促進や瘻孔の閉鎖促進にも有効である可能性が考えられる。そこで本研究では培養小腸上皮細胞を用い、細胞増殖におけるTRの作用を検討すると共に、その作用機序についても検討を行った。 1方法 実験にはヒト胎児小腸正常粘膜上皮細胞由来のFHs74Int細胞(FH細胞)を用いた。この細胞は形態学的に上皮細胞の特徴を備え、接触抑制のかかる細胞である。FH細胞を10%ウシ胎児血清(FCS)を含むDulbecco’s modified Eagle’s medium(DME培地)を用いて培養した。コンフルエントの状態の細胞をさらに無血清培地で24時間培養し静止期に同調した後、EGF,IGF-Iなどの増殖因子、およびTRの作用を検討した。また培養上清中のIGF-Iの測定を行った。 2結果 まずFH細胞の増殖を促進する因子について検討した。静止期FH細胞を10%FCSを含むDME培地で培養するとDNA合成は無血清培地の場合に比べて約10倍増加した。EGF,IGF-IはDNA合成をそれぞれ3倍、2倍に増加させた。EGFとIGF-Iを同時に加えると10%FCSに匹敵する効果を示した(図1)。 次に増殖因子の作用にたいするTRの効果を検討した。図2はEGFの作用に対するTRの効果を示したものである。EGF単独の効果はわずかであるがTRを含んだ培地で予め培養し、その後EGFを加えるとDNA合成は飛躍的に増加する。図3はEGF1nM存在下でのTRの作用の濃度依存性を示したものである。その作用はTR10-9Mから認められ、10-7Mで最大効果を示した。 TRがどのような機序でEGFの作用を増強するかを検討した。その結果TR前処理により培養上清中にEGF作用を増強する因子が放出されていることが判明した。EGFの作用を増強するものとして図1に示すようにIGF-Iがある。そこでTRがはたしてIGF-Iの産生を促進するかをみるために、培養上清中のIGF-IをRIAで測定した。 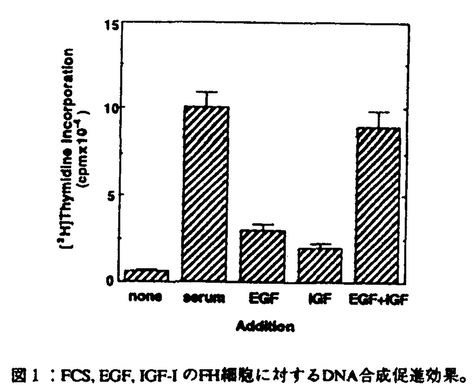 図1:FCS,EGF,IGF-IのFH細胞に対するDNA合成促進効果。 図1:FCS,EGF,IGF-IのFH細胞に対するDNA合成促進効果。 図4に示すようにTRは濃度依存性にIGF-Iの産生・放出を促進した。その濃度依存性は図3に示すEGF作用の増強の濃度依存性とほぼ一致した。IGF-Iの作用を確認するため、抗IGF-I抗体がTRの作用にあたえる影響を検討した。その結果抗IGF-I抗体はTRの作用を大きく減弱した。またTRで処理したFH細胞でRT-PCRを行い、IGF-IのmRNAの発現が確認された。 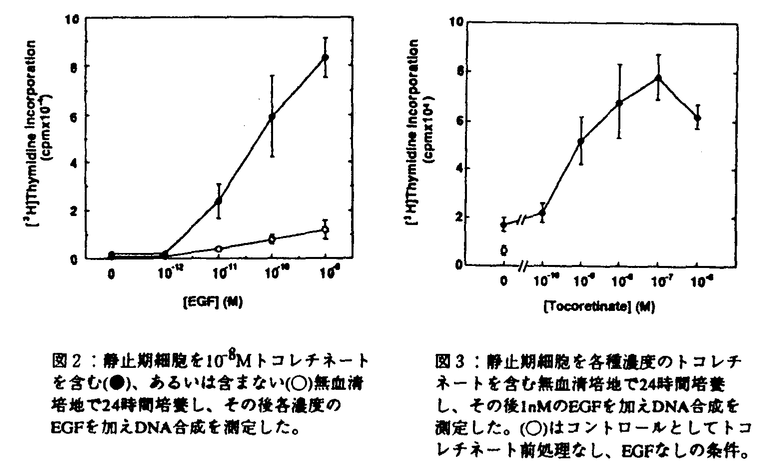 図表図2:静止期細胞を10-8Mトコレチネートを含む(●)、あるいは含まない(○)無血清培地で24時間培養し、その後各濃度のEGFを加えDNA合成を測定した。 / 図3:静止期細胞を各種濃度のトコレチネートを含む無血清培地で24時間培養し、その後1nMのEGFを加えDNA合成を測定した。(○)はコントロールとしてトコレチネート前処理なし、EGFなしの条件。 図表図2:静止期細胞を10-8Mトコレチネートを含む(●)、あるいは含まない(○)無血清培地で24時間培養し、その後各濃度のEGFを加えDNA合成を測定した。 / 図3:静止期細胞を各種濃度のトコレチネートを含む無血清培地で24時間培養し、その後1nMのEGFを加えDNA合成を測定した。(○)はコントロールとしてトコレチネート前処理なし、EGFなしの条件。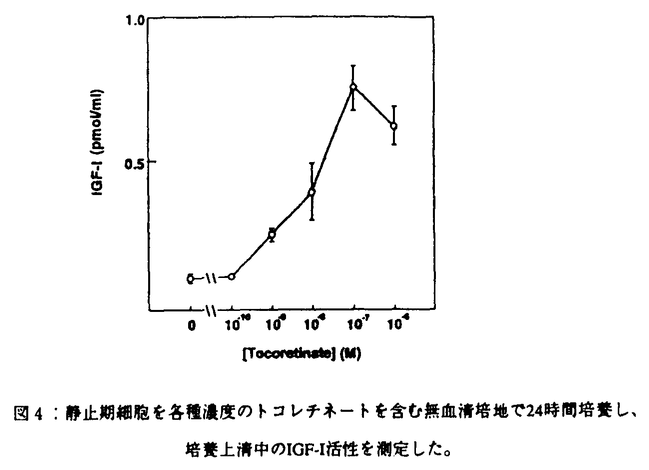 図4:静止期細胞を各種濃度のトコレチネートを含む無血清培地で24時間培養し、培養上清中のIGF-I活性を測定した。3考案 図4:静止期細胞を各種濃度のトコレチネートを含む無血清培地で24時間培養し、培養上清中のIGF-I活性を測定した。3考案 本研究の結果、TRがヒト小腸上皮細胞であるFH細胞の増殖を促進することが明らかになった。TRは特にEGFのDNA合成促進作用を大きく増強した。その作用機序としてTRがEGFの作用に相乗的に働くIGF-Iのオートクリン産生を促進するためであることが明らかになった。小腸細胞はin vivoでIGF-Iを産生し、またIGF-Iの標的細胞であることが知られている。さらに消化管の潰瘍性病変の修復過程にEGF産生細胞が誘導されることが知られている。これらの知見は消化管粘膜の損傷治癒過程においてEGFなどの増殖因子の他にIGF-Iも重要な働きを担っている可能性を示唆するものと考えられる。TRはさまざまな薬理効果をもち、その作用機序の一つとして増殖因子の産生を促進することが考えられた。ところでTRがどのような機序によりIGF-Iのオートクリン産生を促進するかは今後の課題である。おそらくIGF-I遺伝子の転写促進を介する作用であると予想される。 TRは消化管で分解・吸収されないため、経口投与された場合そのままの形で小腸粘膜に達すると予想される。したがって今回in vitroの系で観察された増殖促進作用は実際TRを経口投与した場合にin vivoでも起こりうる可能性があると考えられる。製剤の開発により、消化管病変、例えば炎症性腸疾患の腸管粘膜病変や瘻孔の治癒促進に作用し、臨床的に応用される可能性が考えられる。 |