学位論文要旨
| No | 212555 | |
| 著者(漢字) | 川合,謙介 | |
| 著者(英字) | ||
| 著者(カナ) | カワイ,ケンスケ | |
| 標題(和) | 一過性全脳虚血後の痙攣に関する実験的研究 : ラット心停止蘇生後にみられる聴原性痙攣に注目して | |
| 標題(洋) | ||
| 報告番号 | 212555 | |
| 報告番号 | 乙12555 | |
| 学位授与日 | 1995.11.22 | |
| 学位種別 | 論文博士 | |
| 学位種類 | 博士(医学) | |
| 学位記番号 | 第12555号 | |
| 研究科 | ||
| 専攻 | ||
| 論文審査委員 | ||
| 内容要旨 | 臨床的に虚血性脳障害に続発して痙攣発作やミオクローヌス発作がみられることが知られているが、実験的に脳虚血後の痙攣発生の頻度や経過、またその発生メカニズムを直接対象とした研究はいまだなされていない。しかしこれらは虚血性脳障害の病態や痙攣発生機構についての理解を深める為には避けて通れないテーマである。さらに、心肺蘇生後に痙攣発作の発生をみた症例の予後は特に悪かったとの報告もあり、実験脳虚血後に認められる易痙攣性に注目することは、虚血性脳障害の病態解明や治療を進歩させる上でひとつのアプローチとなるものと思われる。 げっ歯類を用いた実験脳虚血後に痙攣発生をみることは、すでにPulsinelliらの4vessel occlusion model、Smithらの2vessel occlusion+systemic hypotension model、人工髄液大槽注入モデルなどですでに知られていた。最近著者らが確立したラット心停止蘇生モデルは麻酔下に成体ラット縦隔にステンレスフックを挿入し大動脈をクランプすることにより心停止を誘導し、その後人工呼吸および胸郭外心マッサージを加えて蘇生し、一過性全脳虚血を作成するものであるが、このモデルでも虚血後に痙攣発生を認めることはすでに報告した。今回の実験ではこのモデルを用いて虚血後痙攣に注目し、虚血後脳内の 心停止時間はA群:3分、B群:5分、C群:7分、D群:9分とし、大腿動脈カテーテルでモニターした動脈圧が50mmHgまで回復するまでの時間は各々4.5±0.5、8.3±0.7、10.7±0.9、13.7±1.2分であった。B、C、D群のラットは虚血後6時間以内に、A群のラットはそれより早期に覚醒するが、その後B、C、D群ラットのほとんどは数日間触覚刺激や音刺激に対してmyoclonic jerk様の過敏反応を示した。聴覚刺激に対する易痙攣性試験は人為的な混合音を用い、虚血後24時間後、その後は7日毎に行なった。24時間後にはC、D群の100%、B群の65%が陽性であったが、A群はすべて陰性であり、虚血侵襲の程度が強いほど易痙攣発生率が高かった。一部のラットはその後の追跡試験で易痙攣性が陰性化するが、一度陰性となったラットがその後の試験で再び陽性化することはなかった。易痙攣性の消退も虚血侵襲の強度と強く相関していた。すなわち、B群では1週間後までに50%、3週間後までに75%のラットが易痙攣性を失うのに対し、C群およびD群では3週間後までに易痙攣性を失うのは各々26%、38%であった。また、6週間後までにはこれらの群では50%のラットが易痙攣性を失った。8週間後までだとC群ではさらに75%のラットが易痙攣性を失ったが、D群では50%のラットはそのまま易痙攣性を示し続けた。用いたラットはSprague-Dawleyラットが主であったが、Wistarラットでも虚血後同様の痙攣が認められた。また、聴覚刺激以外にストロボ光やリズミカルな触覚または痛覚刺激も試みたが痙攣は誘発されなかった。 痙攣の表現型としては、突然のwild running seizureからtonic-clonic convulsionに移行するという、遺伝的に易痙攣性を示すラット(GEPR)に認められる聴原性痙攣(audiogenic seizrue;AGS)と全く同様のものであった。ただし、一部のラットはwild runningからtonic-clonic seizureを示さずにcatatonic stateに入る型を取った。どちらの型を取るかに関しては虚血侵襲の強さや虚血後経過時間には関係なく、同一のラットが両者の型を取ることもあった。GEPRについてはすでに多くの研究がなされ、AGSのinitiation siteが下丘であること、下丘でのGABA作動性抑制性神経伝達に障害があること、下丘内のGABA作動性介在ニューロンの数が正常ラットよりも増加していること、などがわかっている。虚血後痙攣の表現型がGEPRのAGSと全く同様であったことから、虚血後痙攣についても下丘が焦点であることを仮定し、まず破壊実験を行なった。虚血7日前に定位手術により両側下丘破壊を試みた4匹のラットのうち3匹は易痙攣性を示さず、不完全なrunningを示した1匹のラットでは下丘には不十分な病変しか作成されていなかった。これに対し、聴覚伝導路で下丘の下流にあたる内側膝状体を破壊したラットはすべて虚血後易痙攣性を示し、虚血後AGSでもその発生には下丘が大きく関与していることが判明した。 次に虚血後脳内でのGABA作動性ニューロンの形態学的変化を調べるためにglutamic acid decarboxylase(GAD)に対する免疫組織学的検索を行なった。下丘中心核でGAD陽性細胞数の定量を行なった結果、虚血後の動物ではGEPRとは逆に約50%の細胞数減少を認めた。この減少は下丘中心核の中でも背内側部よりも腹外側部に強く、GEPRではGAD陽性細胞増加がやはり腹外側部により強かったことと比較して興味深い。GEPRではGABA作動性抑制伝達機構に遺伝的障害があるために代償的にGAD陽性細胞数が増加していると推察されているが、虚血後ラットではGAD細胞数の減少そのものがAGSの原因となっている可能性が示唆された。そこで1ヵ月後の時点で易痙攣性を示し続けているラットとそれまでに易痙攣性から回復したラットの下丘中心核GAD陽性細胞数を比較したが両者の間に有意差は認められず、また両者とも7日後ラットとほぼ同様の細胞数であった。したがって、少なくとも虚血後易痙攣性からの回復非回復には下丘内に残存するGABA性ニューロンの数は関係なく、GABA性ニューロン軸素の再構成や抑制を受ける側の下丘relay neuronのGABA受容体の変化、kindling効果による永続的な易痙攣性獲得などが関与している可能性が考えられた。 虚血後脳内で特に脆弱性を示すのは海馬CA1錐体細胞と視床網様核であることが知られている。視床網様核はGABA性ニューロンから構成されており、すべての感覚入力の視床皮質経路に対しフィードバック抑制作用を持つことから視床網様核の虚血後変性がAGSの原因ではないかという意見もある。そこで連続切片を用いて視床網様核内のニューロン脱落部の詳細な分布を調べたところ、変性部位の分布は常に一定のパターンを取っており、吻尾方向・腹背方向ともその中心部に限局していた。すなわち、核の吻側先端より700-800 虚血後下丘でのGABA性抑制伝達の障害をさらに深く追及するためにはin vivoや脳スライスを用いた電気生理学的実験が必要だが、下丘での神経回路が必ずしも完全には明らかにされていないこともあって残念ながら現在利用できる実験パラダイムは存在しない。そこでAGSとの直接の関連は薄いと考えられるが、虚血後の抑制回路の変化をみるためにすでに確立されている海馬歯状回での連発刺激によるシナプス抑制を用いた。これは海馬への入力である穿通路に連発刺激を加えると刺激間時間によって歯状回からの誘発電位や集合スパイクに抑制が認められるパラダイムである。正常ラットでは30msec以下の短い刺激間時間では1回め刺激による集合スパイクに対し2回め刺激による集合スパイクの大きさの減少がみられ、これはGABA-a受容体を介するものと考えられているが、虚血7日後にはこのシナプス抑制は認められないでむしろ増強が認められた。一方、200msec以上の長い刺激間時間では正常動物と同様のシナプス抑制が認められた。虚血2ヵ月後には短時間・長時間とも正常動物と同様のシナプス抑制が保たれていた。 以上示したように、虚血後脳内ではGABAを介した抑制系に広範な形態学的および機能的変化が発生しているものと考えられる。そのうち特に下丘での変化は虚血後のAGSの発生に大きく関与していると考えられた。 | |
| 審査要旨 | 本研究は虚血性脳障害の病態の重要な一側面と考えられる易痙攣性について、ラット心停止蘇生モデルを用いて、一過性全脳虚血後の形態学的および機能的変化を調べたものであり、下記の結果を得ている。 1.心停止蘇生後のラットに認められる痙攣は聴覚刺激によって誘発された。16000Hzを中心とする高周波領域の混合音(約95dB)により、突然のwild runningを始め、その後tonic-clonic convulsionに移行するという、遺伝的に易痙攣性を示すラットに認められる聴原性痙攣と同様の発作であった。 2.心停止時間を3分としたものでは虚血後易痙攣性は認められなかったが、5分では50%のラットに、7分および9分では100%のラットに虚血後易痙攣性を認めた。従って易痙攣発生率は虚血侵襲の強度に相関しているものと考えられた。また、易痙攣性は虚血後24時間以内に発生し、その後徐々に減弱したが、9分虚血ラットの50%は8週間後にも易痙攣性を示し続けていた。易痙攣性の消退も虚血侵襲の強度と強く相関していた。 3.上行性聴覚伝導路のうち、下丘を予め破壊しておくと虚血後易痙攣性の発達は認められないが、内側膝状体を破壊しておいても易痙攣性が認められた。従って、聴覚刺激が聴覚伝導路を上行し異常発火を誘発するには、下丘が重要な役割を演じていることが示された。 4.虚血後脳内での 5.虚血後の聴原性痙攣発生に視床網様核の変性が関与しているという仮説を検証するために、連続切片を用いて視床網様核内のニューロン脱落部の詳細な分布を調べたが、変性部位は体性感覚伝達に関連する領域のF型ニューロンに限局しており、聴覚伝達に関連する部位には変性は認められなかった。 6.虚血後脳でのシナプス伝達抑制の変化を調べるために海馬歯状回での連発刺激によるシナプス伝達抑制を調べた。30msec以下の短い刺激間時間で正常ラットにみられる抑制が、虚血後7日の時点では消失し、むしろシナプス伝達増強が認められた。虚血2ヵ月後にはこのシナプス抑制は回復していた。 以上、本論文は一過性全脳虚血後の脳内においてGABAを介した抑制系に広汎な形態学的および機能的変化が発生していること、そしてそのうち特に下丘における変化は虚血後の聴原性痙攣の発生に大きく関与していることを示した。本研究は、虚血性脳障害の病態解明に重要な貢献をなすものと考えられ、学位の授与に値するものと考えられる。 | |
| UTokyo Repositoryリンク | http://hdl.handle.net/2261/50965 |
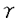 -aminobutyric acid(GABA)系の変化と関連してそのメカニズムを研究対象とした。
-aminobutyric acid(GABA)系の変化と関連してそのメカニズムを研究対象とした。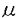 mで変性部位が出現し始め、1.3-1.6mm尾側へ連続していた。最内側および最外側の一層のニューロンは保存されており、ほぼ体性感覚伝達に関連する領域のF型ニューロンの消失と言える。しかし、内側膝状体および聴皮質と連絡を持ちauditory reticular nucleusと呼ばれる腹尾側部分は常に保たれており、視床網様核変性がAGS発生と直接関与する可能性は低いと考えられた。
mで変性部位が出現し始め、1.3-1.6mm尾側へ連続していた。最内側および最外側の一層のニューロンは保存されており、ほぼ体性感覚伝達に関連する領域のF型ニューロンの消失と言える。しかし、内側膝状体および聴皮質と連絡を持ちauditory reticular nucleusと呼ばれる腹尾側部分は常に保たれており、視床網様核変性がAGS発生と直接関与する可能性は低いと考えられた。