| 緒言 近年増加傾向にあるアトピー性疾患(アトピー型気管支喘息、アトピー性皮膚炎)はI型(即時型)アレルギーにより惹起される。したがって抗原のの侵入からIgE抗体産生の過程における制御機構を明らかにすることは、I型アレルギーの本質的な理解を深めるばかりでなく、その治療に大きく寄与すると考えられる。 なかでもサイトカインは、免疫系・造血系などの細胞間情報伝達の一翼を担っていることから、その臨床的有用性が注目されており、今後アレルギーの分野においても臨床的応用が大いに期待されている。 一方、SCID(C.B-17-scid)マウスは1983年にBosma,M.らによって発見された突然変異マウスで、リンパ系細胞のDNA再構成が起こらないことから、機能的なT細胞およびB細胞を欠如した重度複合免疫不全を呈する。 我々は、SCIDマウスにアトピー疾患患者から得た検体(末梢血リンパ球)を移入することにより、マウスの血中でヒトのIgE抗体を検出する系を既に確立した。これまではヒトIgE抗体産生を解析する適切な動物モデルは存在しなかったが、この系を用いサイトカインの臨床学的応用を試みれば、問題は解決すると考えられる。 IgE産生とその制御がT細胞依存性であることは以前からvitroの系で証明されていたが、最近になってCD4+T細胞から放出される2種類のLymphokine-IL-4とIFN-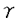 がその中心的な役割を果たしていることが分かってきた。最近、マウスのCD4+細胞がLymphokineの産生パターンからTh1とTh2という2つの細胞群に分けられることが明らかとなった。それはIL-4を分泌するTh2細胞とIFN- がその中心的な役割を果たしていることが分かってきた。最近、マウスのCD4+細胞がLymphokineの産生パターンからTh1とTh2という2つの細胞群に分けられることが明らかとなった。それはIL-4を分泌するTh2細胞とIFN-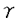 を分泌するTh1細胞である。Th1細胞とTh2細胞はB細胞に対し、その分化および抗体産生細胞への誘導に対し、相反したLymphokineを産生し、たがいに拮抗すると考えられている。 を分泌するTh1細胞である。Th1細胞とTh2細胞はB細胞に対し、その分化および抗体産生細胞への誘導に対し、相反したLymphokineを産生し、たがいに拮抗すると考えられている。 本論文では、アトピー患者の末梢血リンパ球を移入したSCIDマウスを用いることによりヒトIgEを産生する系を用い、CD4、CD8陽性細胞の分離除去による移入およびIgE抗体産生における代表的な調節因子であるIFN-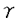 ,IL-4に対する抗体anti IL-4 antibodyを投与し、いわばin vivoにおける条件下でヒトのIgE産生の調節機序について解析、サイトカインの臨床学的応用について考案を加えた。 ,IL-4に対する抗体anti IL-4 antibodyを投与し、いわばin vivoにおける条件下でヒトのIgE産生の調節機序について解析、サイトカインの臨床学的応用について考案を加えた。 材料ならびに方法1.アトピー患者および健常人末梢血からの表面マーカーによる単核球の分離 対象はアトピー型の気管支喘息もしくはアトピー性皮膚炎患者3名で、コントロールとして健常人2名より採血した。 採血後、Ficoll-Hypaqueを用い比重分離を行い、得られた末梢血単核球(PBMC)はHANK’s液にて4℃まで除々に冷却し、3回洗浄を行った。得られた細胞の純度および生存率(viability)は99.5%以上である。さらにPBMCからCD2、CD4およびCD8陽性細胞を1次抗体標識付着磁気ビーズDYNABEADS (DYNAL社、ノルウェイ)を用いて負の選択を行った。 (DYNAL社、ノルウェイ)を用いて負の選択を行った。 このようにして得られた細胞分画をマウスへ移入する細胞として実験系に用いた。 2.マウスのストレインおよび細胞移入 実験に用いたマウスはCB-17-Scid、BALB/CA-nuの2つのストレインでいずれも雄6-8週令を用いた。 細胞の移入経路は腹腔内移入、経静脈移入の2通りで、1群5匹とし対照群をもう一群おいて行った。 移入した細胞数は2×106/匹、1×107/匹、5×107/匹の3群間で比較検討した。細胞移入後、経時的にマウスの眼底静脈叢より200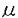 1ずつ採血し、その血清中のヒトIgE抗体、IgG抗体をアッセイした。 1ずつ採血し、その血清中のヒトIgE抗体、IgG抗体をアッセイした。 3.IgE調節因子の投与およびh-IgEの測定系 IFN-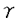 は、human reconbinant IFN- は、human reconbinant IFN-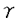 として、1×105U/匹を21日間連日マウスへ腹腔内投与した。IL-4に対する抗体は0.4mg/匹にて単回、腹腔内投与した。h-IgEならびにIgGの測定はサンドイッチELISAにてアッセイした。得られたデータはT検定を行ない、危険率5%以下を有意差ありと解釈した。 として、1×105U/匹を21日間連日マウスへ腹腔内投与した。IL-4に対する抗体は0.4mg/匹にて単回、腹腔内投与した。h-IgEならびにIgGの測定はサンドイッチELISAにてアッセイした。得られたデータはT検定を行ない、危険率5%以下を有意差ありと解釈した。 結果(1)SCIDマウス血中でのヒトIgE抗体の検出 SCIDマウス血清中でヒトIgEを検出するためには、マウス一匹あたり5×107個のアトピー患者PBMCの移入が必要であった。ヌードマウスでは同数の細胞移入においてヒトIgEは検出できなかった。移入経路に関しては腹腔内移入によってのみIgEは検出でき、静脈内の移入ではまったく検出できなかった。 (2)SCIDマウス血中でのヒトIgE抗体産性の動態 IgEは患者PBMC移入後2週目からマウス血清中に検出できるようになり、3から4週でピークに達し、以後減少した。IgGはIgE同様に移入後2週目から検出されたが、その後徐々に上昇し、移入後少なくとも3か月まで検出できた。1×107個と比較的少ないPBHCの移入でもIgGの産生はほぼ同様のパターンを示した。 (3)SCIDマウス血中でのヒトIgE抗体産生の調節 SCIDマウス内でのIgE産生にはB細胞のみの移入では認められず、PBMC中のCD4陽性T細胞の存在が必要であった。CD8陽性細胞を除去することによって細胞移入後3〜4週でIgE産生はエンハンスされ、かつ持続的産生に移行した。 IFN-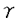 投与群では投与2週および3週後において有意(p<0.05)にIgE抗体産生抑制がみられ4週以降もその傾向がみられており、6週以降で抗体産生における差異は消失した。IgG抗体産生では、IFN- 投与群では投与2週および3週後において有意(p<0.05)にIgE抗体産生抑制がみられ4週以降もその傾向がみられており、6週以降で抗体産生における差異は消失した。IgG抗体産生では、IFN-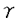 投与群、非投与群で産生量には差異は認められなかった。IL-4に対する抗体を0.4mg/匹で腹腔内投与し、同時にアトピー患者のPBMCを移入した際の比較において、anti IL-4投与群では投与2週で有意(p<0.05)にIgE抗体産生の抑制がみられた。 投与群、非投与群で産生量には差異は認められなかった。IL-4に対する抗体を0.4mg/匹で腹腔内投与し、同時にアトピー患者のPBMCを移入した際の比較において、anti IL-4投与群では投与2週で有意(p<0.05)にIgE抗体産生の抑制がみられた。 考案 SCIDマウス血清中でヒトIgEを検出するためには、マウス一匹あたり5×107個のアトピー患者PBMCの移入が必要であった。IgEは患者PBMC移入後2週目からマウス血清中に検出できるようになり、3から4週でピークに達し、以後減少する。しかし、IgGの産生パターンは明らかにIgEと異なっていた。IgGはIgE同様に、移入後2週目から検出できるようになるが、その後上昇し、少なくとも3ヵ月まで検出できた。1×107個と比較的少ないPBMCの移入でもIgGの産生は同様のパターンを示すことから、単に移入されたB細胞数の問題ではないと考えられる。この結果から、移入されたB細胞のIgEとIgG産生に関して、その調節機序が異なることが示唆された。 SCIDマウスに移入された患者PBMCがどのような機序のもとにIgEを産生しているか、その調節機構を調べる目的で、CD2+、CD4+およびCD8+細胞を除去したPBMCをSCIDマウスに移入した。その結果、SCIDマウスでのIgE産生にはB細胞のみの移入では認められず、PBMC中のCD4+T細胞の存在が必要であることが分かった。このことから、患者のPBMC中のすでに分化しているIgE産生細胞はSCIDマウス内で早期に不活化または死滅し、移入時にはIgEを産生していない抗体産生前駆細胞がCD4+T細胞によってIgE産生細胞に分化誘導されたと考えた。 IgE産生はT細胞の支配下にあり、ここ数年間でそれが相反する作用をもつ二つのT細胞因子-IL-4とIFN-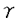 -によるものであることが強く支持されてきた。 -によるものであることが強く支持されてきた。 患者PBMC移入後のSCIDマウス内でのIgE産生がすでに分化したIgE産生細胞でないことから、SCIDマウス内で患者PBMC中のCD4+細胞が分泌するIL-4によって抗体産生前駆細胞がIgE産生細胞に分化したと推察された。 SCIDマウス体内でCD4+細胞によって分化したIgE抗体産生細胞は長時間その産生が持続するIgGとは異なり、5〜6週という比較的短期間のみIgEを産生するに過ぎない。しかしながら、患者PBMCからCD8+細胞を除去することによって、IgE産生は増強され、また持続産生に移行することが分かった。 このことはin vivoにおいてCD8+細胞がIgE産生細胞に抑制的に働いていることを強く示唆している。CD8+細胞もCD4+細胞と同様にIFN-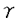 を産生することが知られている。したがって、患者の活性化した主にIL-4を分泌するCD4+細胞が抗体産生前駆細胞のIgE産生細胞への分化を促し、逆にIFN- を産生することが知られている。したがって、患者の活性化した主にIL-4を分泌するCD4+細胞が抗体産生前駆細胞のIgE産生細胞への分化を促し、逆にIFN-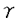 を分泌するCD8+細胞がSCIDマウス体内で、いわばin vivoの環境下においてもそれを抑制していると結論できる。 を分泌するCD8+細胞がSCIDマウス体内で、いわばin vivoの環境下においてもそれを抑制していると結論できる。 近年、Th2サイトカインが接着分子の発現、炎症細胞の浸潤そしてその活性化を介してアトピー性疾患の慢性化や増悪に関与していることが明らかになりつつある。 したがって、アトピー性疾患の治療には、IgE抗体産生の抑制も含め、Th2細胞の分化や活性化を抑制することが重要かと思われる。アトピー性疾患におけるサイトカインの1日も早い臨床応用を切に願うとともに、今回の系も含め、実験動物を用いたモデルによるin vivoにおけるより詳細なサイトカインネットワークの解析が望まれる。 |