| 内容要旨 | | 1,序 強皮症は皮膚硬化,肺線維症などの線維化病変とレイノー現象や皮膚潰瘍等の血管病変を主体とする原因不明の全身性結合組織病である.高率に自己抗体の出現を伴うことから,免疫異常が病因に関与していると考えられている.本症では自己抗体の中でも,細胞に普遍的に存在しDNAの高次構造を変換する核内酵素であるDNAトポイソメラーゼI(トポI)に対する抗体(抗トポI抗体)が特徴的に出現する.抗トポI抗体の強皮症に対する特異性は極めて高く,強皮症の病因と深く結び付いていると推定され,抗トポI抗体の産生機序解明は強皮症の病因解明の糸口となると思われる. 一般に自己抗体の産生機序として,調節性T細胞の異常,ポリクローナルB細胞活性化,抗原誘導性免疫,及び外来抗原との交差反応などが提唱されている.強皮症ではSLEなどに比べ,出現する自己抗体の種類が抗トポI抗体を含めた比較的少数のものに限られていること,そして抗トポI抗体の強皮症に対する特異性が極めて高いことから,トポI特異的な要因が関与していると考えられる.最近の研究で,トポI上の複数個の抗原決定基が同定されており,抗原誘導性免疫,すなわちトポIに対する特異的T細胞が活性化されていることが示唆されている.一方,トポIがレトロウイルスの蛋白であるp30gagと相同アミノ酸配列を持ち,その部位が抗原決定基になっているという報告があり,これは外来抗原との交差反応によりトポIが認識されている可能性を示唆している. こうした背景から,抗トポI抗体の産生機序を知る上で,強皮症患者血清のトポI認識様式を詳しく調べることは重要な意味をもつ.本研究では,トポIの遺伝子を5つの部分に分割し,大腸菌にてリコンビナント蛋白として発現させ,さらに重要な部分については一連の削除変異株を作製し,同様にリコンビナント蛋白として発現させ,強皮症患者血清との反応性を検討した. 2,方法と結果 ヒトトポIの全長cDNAクローン(T1B)はD’Arpaらによってクローニングされた.蛋白コード領域は2298塩基で765アミノ酸をコードする.抗原決定基を検索する為にトポI遺伝子の蛋白コード領域を5つに分け,それぞれを大腸菌用蛋白発現ベクター(pTEX7)に挿入した(FA,FB,FC,FDおよびFE,図1).それぞれの領域は前後の領域と少なくとも6アミノ酸重なるように設計した.このベクターにより各領域は -ガラクトシダーゼとの融合蛋白として発現された. -ガラクトシダーゼとの融合蛋白として発現された. 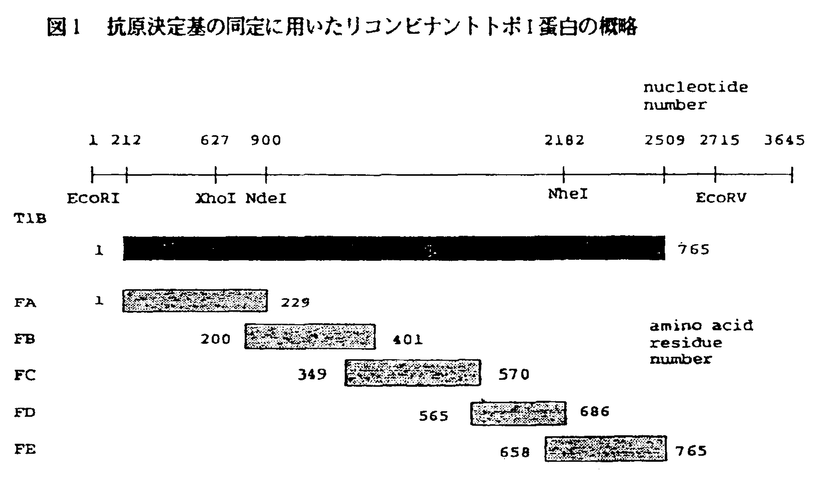 図1 抗原決定基の同定に用いたリコンビナントトポI蛋白の概略 図1 抗原決定基の同定に用いたリコンビナントトポI蛋白の概略 これらの融合蛋白を粗精製した後,すでに二重免疫拡散法にて抗トポI抗体陽性の確認されている35人の患者血清との反応性をウエスタンプロット法により検討した.SDS-PAGE上,リコンビナントFB,FC,FDおよびFE蛋白ははっきりした1本のバンドを形成したが,リコンビナントFA蛋白は2本のバンドを形成した(FA/UおよびFA/L).これはおそらく大腸菌由来の蛋白分解酵素が働いたためと考えられた.各融合蛋白の血清に対する反応性はFA/U40%,FA/L34%,FB46%,FC100%,FD29%,およびFE71%であった.FA蛋白の2本のバンドの反応性が異なることから,FA領域には少なくとも2つの抗原決定基があると考えられた.また,ELISAおよびウエスタンブロット法による検討では,各領域の蛋白でアフィニティー精製した抗体は他の領域に反応を示さず,複数の領域と反応する血清を1領域の蛋白で吸収しても他の領域への反応は依然認められた.この結果からFA-FEの各領域が独立した抗原決定基をもつことが確認された. 調べた35血清中32の血清はFA-FEのうちの複数の領域と反応しており,平均して1血清あたり3個以上の抗原決定基と反応することが見いだされた.これらの結果を要約すると,トポI分子上には少なくとも6つの抗原決定基が存在し,大多数の患者血清は複数の抗原決定基を認識していると結論された. 興味深いことには,調べた35血清すべてがFC領域に反応を示し,さらにそのうちの3血清はFC領域のみに反応を示した.そこで,FC領域中の同一の抗原決定基が共通して認識されているのかどうかをまず検討した.すなわち,FC領域をコードする遺伝子を3’側から削っていき,9つの削除変異株を作製し,それに相当するFC領域のC末の欠如した融合蛋白(FCd1-FCd9)を調整した.そしてウエスタンブロット法により,前述の35血清との反応を検討した.その結果,調べたすべての血清で,FCd1(アミノ酸残基,349-565)に対する反応は強くはっきりしているが,FCd2(アミノ酸残基,349-546)およびそれより短いFCd3-FCd9に対する反応は無いか極端に弱いものであった.これはすべての血清がアミノ酸残基547-565の小領域に関連する抗原決定基を認識していることを示しており,おそらく同一の抗原決定基を認識していると考えられた.この抗原決定基をトポIの<普遍的抗原決定基>と呼ぶこととした.なお,ELISAでの検討では,FC領域に対する抗体価が他の領域に対する抗体価に比べ高いという傾向はなく,この抗原決定基が普遍的に認識されるのは少なくとも抗原性が強いという理由ではないと思われた.また,この普遍的抗原決定基はすでに報告されているレトロウイルスp30gag蛋白との相同性抗原決定基とは別の部位であった. 削除変異株を用いた検討からFC領域のみに反応した3血清もこの普遍的抗原決定基のみを認識していることが判明した.これは二重免疫拡散法およびELISA法でも確認された.さらにこのうちひとりの患者血清は2年以上にわたり普遍的抗原決定基のみを認識していることが分かった. 3,考察 本研究では,抗トポI抗体の産生機序を解明するため,強皮症患者血清のトポI認識様式をリコンビナントトポI蛋白を用いて検討した.得られた結果をまとめると以下の3点である. 1)大多数の患者血清はトポI蛋白上の複数個の抗原決定基を認識する. 2)調べたすべての患者血清で認識される言わば普遍的抗原決定基が存在する. 3)一部の患者ではこの普遍的抗原決定基のみを長期にわたり認識している. 1)の結果は,トポI蛋白の複数個の抗原決定基のそれぞれに特異的なB細胞が活性化されていることを示しており,それにはトポI特異的なT細胞(自己反応性T細胞)のヘルプが働いている(抗原誘導性免疫)と考えるのが妥当であろう.例えば,自己抗原が単なる交差反応により認識されているならば,認識される抗原決定基は交差反応を示すそれに限られると考えられるからである. 2)の普遍的抗原決定基は他の抗原決定基に比べ抗原性が強いわけではないのに,調べたすべての患者血清で認識される点で興味深い.この抗原決定基の認識がトポIの認識になんらかの必然性を持っている可能性があろう. 3)の結果から得られる結論は1)と一見相反する.すなわち抗体の認識できる部位は少なくとも6個はあるのにもかかわらず,2年以上にわたり<普遍的抗原決定基>以外の抗原決定基を認識しない患者血清があることはT細胞のヘルプが働いていることに合致しない.トポI特異的なT細胞が活性化されていれば,他の抗原決定基に対する特異的B細胞も活性化されると思われるからである.この例では,むしろ交差反応など個々の抗原決定基固有の要因によって認識されていると考えた方が自然である. 1)-3)の結果を合理的に説明するために,交差反応から抗原誘導性免疫へ進展する経路の存在を想定した.B細胞に抗原提示能があることは以前より報告されているが,特に活性化されたB細胞による特異抗原提示能は非特異抗原提示能に比べ格段に効率的であることが知られている.このことから、外来抗原とトポI分子に相同性抗原決定基が存在すれば,外来抗原に対する免疫反応において活性化されたB細胞がトポIの相同性エビトーブを認識し,不応答化されていた自己トポI反応性T細胞に自己トポIを抗原提示し,それを活性化する.そして,そのトポI反応性T細胞がトポIの他の抗原決定基を認識するB細胞の活性化を助け,複数個の抗原決定基の認識につながるという経路である.この場合,トポI分子上の相同性抗原決定基の認識は必須であるから,それが普遍的抗原決定基として検出されるわけである.また,本研究で観察された普遍的抗原決定基のみを認識している血清は,未だ交差反応の段階に留まっていると推定されよう. 最近Linらがマウスの系でこの経路の存在を支持する結果を報告している。すなわち,ヒトチトクロームCで免疫したマウスからB細胞を採取し,自己抗原であるマウスチトクロームCとともに同系マウスに移入すると,そのマウスにマウスチトクロームC特異的T細胞が出現した.すなわち,ヒトチトクロームCとの交差反応からマウスB細胞が自己チトクロームCをT細胞に抗原提示したと考えられる。 以上のことから,抗トポI抗体の産生機序として,交差反応から抗原誘導性免疫へ進展する経路を検討することは重要と考えられ,交差反応性外来抗原の検索などを含め,さらなる研究が必要である。 |
| 審査要旨 | | 本研究は原因不明の全身性結合組織病である強皮症の病因をその特徴的な免疫異常の面から検討したものである。すなわち、本症ではDNAの高次構造を変換する細胞核内酵素であるDNAトポイソメラーゼI(トポI)に対する抗体(抗トポI抗体)が特徴的に出現するため、この抗トポI抗体の産生機序の解明を行っている。これまで自己抗体の産生機序として,調節性T細胞の異常,ポリクローナルB細胞活性化,抗原誘導性免疫,及び外来抗原との交差反応などが提唱されている.抗トポI抗体の産生機序がこれらのどれに属するのかあるいは新たな機序によるのかを検討するため、トポIの遺伝子を5つの部分に分割し,大腸菌にてリコンビナント蛋白として発現させ,さらに重要な部分については一連の削除変異株を作製し,強皮症患者血清との反応性を検討している。 得られた知見は以下の通りである。 1)トポI蛋白上には抗原決定基となりうる部分が少なくとも6つあり、大多数の患者血清は複数個の抗原決定基を認識している.この結果は,複数個の抗原決定基のそれぞれに特異的なB細胞が活性化されていることを示しており,それにはトポI特異的なT細胞(自己反応性T細胞)のヘルプが働いている(抗原誘導性免疫)と考えられる.例えば,自己抗原が単なる交差反応により認識されているならば,認識される抗原決定基は交差反応を示すそれに限られると考えられるからである. 2)調べたすべての患者血清で認識される言わば普遍的抗原決定基が存在する.普遍的抗原決定基は他の抗原決定基に比べ抗原性が強いわけではないのに,調べたすべての患者血清で認識される点で興味深い.この抗原決定基の認識がトポIの認識になんらかの必然性を持っている可能性があろう. 3)一部の患者ではこの普遍的抗原決定基のみを長期にわたり認識している.この結果から得られる結論は1)と一見相反する.すなわち抗体の認識できる部位は少なくとも6個はあるのにもかかわらず,2年以上にわたり<普遍的抗原決定基>以外の抗原決定基を認識しないことはT細胞のヘルプが働いていることに合致しない.トポI特異的なT細胞が活性化されていれば,他の抗原決定基に対する特異的B細胞も同様に活性化されると思われるからである.この例では,むしろ交差反応など個々の抗原決定基固有の要因によって認識されていると考えた方が自然である. 4)1)-3)の結果を合理的に説明するために,交差反応から抗原誘導性免疫へ進展する経路の存在を想定している.B細胞に抗原提示能があることは以前より報告されているが,特に活性化されたB細胞による特異抗原提示能は非特異抗原提示能に比べ、格段に効率的であることが知られている。このことから、外来抗原とトポI分子に相同性抗原決定基が存在すれば,外来抗原に対する免疫反応において活性化されたB細胞がトポIの相同性エビトーブを認識し,不応答化されていた自己トポI反応性T細胞に自己トポIを抗原提示し,それを活性化する.そして,そのトポI反応性T細胞がトポIの他の抗原決定基を認識するB細胞の活性化を助け,複数個の抗原決定基の認識につながるという経路である.この場合,トポI分子上の相同性抗原決定基の認識は必須であるから,それが普遍的抗原決定基として検出されるわけである.また,本研究で観察された普遍的抗原決定基のみを認識している血清は,未だ交差反応の段階に留まっていると推定されよう. 以上,本論文は強皮症における自己抗原トポIに対する反応が基本的には抗原誘導性免疫であることを示しているが、同時にむしろ交差反応による認識と考えたほうが適切と思われる血清もあることを報告している。そして、今回初めて報告した普遍的抗原決定基の存在を軸に交差反応から抗原誘導性免疫に進展するという仮説を提唱している.本研究は強皮症における特異的自己抗体、抗トポI抗体の産生機序の解明に重要な貢献をなすものと考えられ、学位の授与に値すると考えられる. |