麹菌Aspergillus oryzaeは日本の伝統的な発酵食品の製造に欠かすことのできない種麹として使用されてきた。また、麹菌が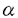 -アミラーゼ、グルコアミラーゼなどの糖質加水分解酵素やプロテアーゼなどを大量に細胞外に生産するために、近代発酵工業において重要な菌株として位置付けられている。さらに、近年の遺伝子組換え技術の発展と相まって麹菌A.oryzaeは異種タンパク質生産の安全性の高い宿主としても重要になってきている。一方、酵母による異種タンパク質の発現において、細胞外に大量に異種タンパク質が分泌生産させれば、連続的培養による効率的生産、生産されたタンパク質の精製の容易さ等の工業的な利用だけでなく、タンパク質工学的手法によりタンパク質の構造と機能を解明するための変異タンパク質生産にも利用することができる。このような利点より、各種の検討がなされてきた。たとえば、異種タンパク質を高生産する株の育種、強力なプロモーターの利用したベクターの開発、効率よく細胞外にタンパク質を分泌するためのシグナルペプチドの利用、培養条件の改良などがあげられる。 -アミラーゼ、グルコアミラーゼなどの糖質加水分解酵素やプロテアーゼなどを大量に細胞外に生産するために、近代発酵工業において重要な菌株として位置付けられている。さらに、近年の遺伝子組換え技術の発展と相まって麹菌A.oryzaeは異種タンパク質生産の安全性の高い宿主としても重要になってきている。一方、酵母による異種タンパク質の発現において、細胞外に大量に異種タンパク質が分泌生産させれば、連続的培養による効率的生産、生産されたタンパク質の精製の容易さ等の工業的な利用だけでなく、タンパク質工学的手法によりタンパク質の構造と機能を解明するための変異タンパク質生産にも利用することができる。このような利点より、各種の検討がなされてきた。たとえば、異種タンパク質を高生産する株の育種、強力なプロモーターの利用したベクターの開発、効率よく細胞外にタンパク質を分泌するためのシグナルペプチドの利用、培養条件の改良などがあげられる。 本研究では以上を背景にして、酵母Saccharomyces cerevisiaeにおける麹菌遺伝子の発現と高生産方法を確立し、この方法を用いて部位特異的に変異を導入した麹菌遺伝子を発現し、変異タンパク質を解析すること、さらに新しい酵母宿主ベクター系を開発し、これを酵母実用株に応用し、この株での麹菌遺伝子の発現を目的として行ったものである。 麹菌Aspergillus oryzaeの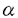 -アミラーゼcDNAまたはヒトリゾチーム合成DNAを導入した酵母形質転換株を選択培地で30℃full growthまで前培養した。集菌した菌体を栄養培地に移植し、15℃で2日間、さらに30℃で2日間振とう培養した。このような低温培養法により培養された酵母形質転換株は -アミラーゼcDNAまたはヒトリゾチーム合成DNAを導入した酵母形質転換株を選択培地で30℃full growthまで前培養した。集菌した菌体を栄養培地に移植し、15℃で2日間、さらに30℃で2日間振とう培養した。このような低温培養法により培養された酵母形質転換株は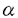 -アミラーゼ、ヒトリゾチームをそれぞれ28.6mg/l、6.1mg/lの高い生産性を示した。これは通常の30℃で培養した場合の約2倍の生産量であった。このように酵母形質転換株を15℃の低温で培養することで異種タンパク質が高生産されることを見出し、新しい培養法を設定した。 -アミラーゼ、ヒトリゾチームをそれぞれ28.6mg/l、6.1mg/lの高い生産性を示した。これは通常の30℃で培養した場合の約2倍の生産量であった。このように酵母形質転換株を15℃の低温で培養することで異種タンパク質が高生産されることを見出し、新しい培養法を設定した。 低温培養法による異種タンパク質の生産において、ADH1あるいはGAPDHプロモーターをもつYEp、YCpあるいはYIpの酵母発現ベクターの何れを用いても30℃一定の通常培養法に比べて約2倍の高生産性を示した。この低温培養法による異種タンパク質の高生産性は今回、主に使用した酵母S.cerevisiae YPH250株に特異的な現象ではなかった。また、異種タンパク質として麹菌グルコアミラーゼおよびフィターゼ(ミオイノシトール-6リン酸 ホスフォヒドロラーゼ)を生産させたところ、30℃一定の通常培養法に比べて約2倍の高生産性を示したことより種々の異種タンパク質の生産に本低温培養が有効と示唆された。 アルギナーゼをコードするCAR1遺伝子を選択マーカーとし、multi-cloning siteをもつYCp型およびYEp型のベクターを作製した。これらのプラスミドによる形質転換頻度は実験室株では約900/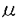 gDNA、約100/ gDNA、約100/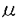 gDNAであった。清酒酵母協会9号、10号のcar1変異株に麹菌 gDNAであった。清酒酵母協会9号、10号のcar1変異株に麹菌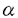 -アミラーゼcDNAを形質転換により導入し -アミラーゼcDNAを形質転換により導入し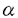 -アミラーゼを生産する清酒酵母を造成した。また、car1変異株を親株としてura3変異株を取得し、得られた2重変異株に -アミラーゼを生産する清酒酵母を造成した。また、car1変異株を親株としてura3変異株を取得し、得られた2重変異株に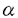 -アミラーゼcDNA(マーカーとしてCAR1遺伝子)とヒトリゾチーム合成DNA(マーカーとしてURA3)を含む2種類のプラスミドを同時に導入し、形質転換株でそれぞれの発現を示すハローを確認した。これらの2種類のプラスミドを持つ形質転換株から、CAO培地あるいはFOA培地を用いてそれぞれ選択的にCAR1またはURA3プラスミドを脱落させることが可能であるかを検討したところ、ハロー形成性および栄養要求性から、目的とするプラスミドを効率よく除去することが可能であった。 -アミラーゼcDNA(マーカーとしてCAR1遺伝子)とヒトリゾチーム合成DNA(マーカーとしてURA3)を含む2種類のプラスミドを同時に導入し、形質転換株でそれぞれの発現を示すハローを確認した。これらの2種類のプラスミドを持つ形質転換株から、CAO培地あるいはFOA培地を用いてそれぞれ選択的にCAR1またはURA3プラスミドを脱落させることが可能であるかを検討したところ、ハロー形成性および栄養要求性から、目的とするプラスミドを効率よく除去することが可能であった。 パン品質の多様化と米などのデンプン質を利用できる等の観点より新しいパン用酵母を育種した。宿主としては、マルトース発酵能は通常のパン酵母より若干おとるものの、香味の良いパンを製造することが確認されたOC-2(ワイン酵母)を用い、麹菌グルコアミラーゼを生産する株を造成した。OC-2株は原栄養株であり選択マーカーをもたないので、形質転換のための栄養要求マーカーとして遺伝子破壊によりトリプトファン要求を付与した株、OC-2T、を造成した。このOC-2T株にYEpタイプおよびYIpタイプの発現プラスミドによりグルコアミラーゼcDNAを導入し、形質転換株を作製した。これらの形質転換株はそれぞれプラスミド安定性の欠如のためと、低コピー数のために、グルコアミラーゼ生産性が十分ではなかった。そこで、酵母レトロトランスポゾンTy1のデルタ配列を利用した組込み型ベクターにグルコアミラーゼcDNAを連結し、これをOC-2T株に導入することにより、安定にグルコアミラーゼを高生産する株を造成することができた。さらに、OC-2がホモタリズム株であることを利用して、胞子形成後の自動的に2倍体化させることにより、一方の染色体に組込まれたグルコアミラーゼcDNAをホモにもつ株を単離することによりそのコピー数を倍化することをこころみたところ、ほぼコピー数に比例し高生産する株を取得することが可能であった。 麹菌A.oryzaeのグルコアミラーゼのC末端領域の機能解析をするために部位特異的変異法によりグルコアミラーゼcDNAにストップコドンを挿入し、変異cDNAを作製した。野生型とC末端ドメインを欠失した変異型のグルコアミラーゼcDNAを酵母Sacchromyces cerevisiae YPH250に導入した後、両酵素を生産した。生産されたグルコアミラーゼをアカボースをリガンドとするアフィニティカラムクロマトグラフィーにより精製した。両酵素ともマルトオリゴ糖に対するKmはほとんど同じであったが、可溶性デンプンに対するKmは変異型の方が大きかった。また、変異型グルコアミラーゼは生デンプンをほとんど分解しなかったが、野生型はよく分解した。麹菌A.oryzaeのグルコアミラーゼのC末端領域も生デンプン吸着の機能を持つと考えられた。 タンパク質工学により、タカアミラーゼAのアミノ酸残基の機能を解析するために本酵素のcDNAを単離した。X線構造解析により推定されている触媒活性部位および基質結合部位のアミノ酸残基を部位特異的変異法により改変した。Asp206、Glu230、Asp297およびLys209をそれぞれAsnとGlu、GlnとAsp、AsnとGlu、およびPheとArgに置換した。改変したcDNAをADH1プロモーターをもつ酵母発現ベクターに連結し、酵母Sacchromyces cerevisiae YPH250に導入した。得られた全ての形質転換株がタカアミラーゼA抗体と交差反応する変異タカアミラーゼAを生産した。Asp206、Glu230およびAsp297を改変した変異タカアミラーゼAの -アミラーゼ活性は低温培養によるプレートアッセイでも検出できず、これらのアミノ酸が活性触媒残基であることが示唆された。また、Lys209をArgに改変した変異タカアミラーゼAは割合強い -アミラーゼ活性は低温培養によるプレートアッセイでも検出できず、これらのアミノ酸が活性触媒残基であることが示唆された。また、Lys209をArgに改変した変異タカアミラーゼAは割合強い -アミラーゼ活性を示し、Phcに改変したタカアミラーゼAの -アミラーゼ活性を示し、Phcに改変したタカアミラーゼAの -アミラーゼ活性は検出出来なかったことより、本残基は塩基性のアミノ酸であることが必須と推測された。 -アミラーゼ活性は検出出来なかったことより、本残基は塩基性のアミノ酸であることが必須と推測された。 |