ヒト白血病の染色体分析により、これまでに多くのノンランダムな染色体転座が同定された。近年これらの転座の切断点近傍から、発癌に関与していると考えられる遺伝子が分離されてきたが、その多くは転写調節因子である。例えば、1:19転座型急性リンパ性白血病では、19番染色体p13バンド(19p13)上に座位するへリックスーループ-ヘリックス構造をもったE2A遺伝子とIq23上にあるpbx1遺伝子が融合する結果、病的なE2A-pbx1融合タンパクを発現し、発癌に至ると考えられるようになった。 われわれは小児急性リンパ性白血病483例の染色体分析結果を検討し、4例にt(17:19)(q22:p13)の異常を認めた。このうち検体が得られた3例についてサザンブロット法にてE2A遺伝子の再構成の有無を検討したところ、2例について再構成が認められたため(症例1、2)、融合遺伝子の分離とその生化学的性状の分析を行った。 切断点近傍のゲノム構造を分析するため、症例1の白血病細胞より抽出したDNAから作成したゲノム・ライブラリーをE2Aプローブでスクリーニングし、再構成したDNAをクローニングした。切断点は1:19転座型白血病と同じE2A遺伝子の第13イントロン内に存在した。次に症例1の再発時芽球より樹立した細胞株(UOC-B1)より抽出したmRNAをE2Aプローブを用いノーザンブロット法にて分析したところ、正常のE2AのmRNA以外に4.4Kb、4.8Kbの2種類の異常なmRNAを検出した。UOC-B1細胞のmRNAより作成したcDNAライブラリーをE2Aプローブでスクリーニングし、これらの異常mRNAをクローニングしたところ、これらのmRNAは3’末端の非翻訳領域のみの相違であり、5’側はE2A遺伝子由来、3’側は17番染色体由来の未知の遺伝子の配列をもつ融合遺伝子と判明した。 17番染色体由来の遺伝子をクローニングするために、融合遺伝子の3’側の配列をプローブとして各種の細胞株や正常組織のmRNAをノーザンプロット法にて分析したところ、肝臓と肝癌細胞株HepG2に3.5Kbと4.0Kbの2種類のmRNAを、腎臓に4.0KbのmRNAを検出したため、HepG2のcDNAライブラリーをスクリーニングした。得られた遺伝子は、3’末端の非翻訳領域のみ異なる2種類のクローンからなり、295アミノ酸残基よりなる未知のタンパク(hepatic leukemia factor、HLF)をコードしていた。HLFはロイシンジッパー(bZIP)因子に属する転写調節遺伝子で、とりわけDBP(albumin D-box binding protein)、TEF(thyrotroph embyonic factor)の2因子とは、DNA結合領域、ロイシンジッパー領域のみならず、そのアミノ末端側にあるPAR(proline and acidic amino acid rich)領域を含めて高い相同性を示した。 UOC-B1細胞株よりクローニングされたE2A-HLF融合遺伝子の塩基配列と、E2A、HLFの両遺伝子を比較したところ、5’末端はE2A、3’末端はHLF由来であったが、その間に59塩基対からなるどちらの遺伝子にも属さない「介在配列」を認めた。症例2の芽球より抽出したRNAからE2A-HLF融合mRNAをPCR法にて増幅し塩基配列を決めたところ、86塩基対よりなる同様の介在配列を認めた。これらの配列の由来を決めるため、2症例のゲノムの塩基配列と胎盤由来の正常のゲノムの配列を比較したところ、切断点に20(症例1)、25(症例2)塩基対からなる由来不明の配列が挿入されており、これを挟んで、E2A遺伝子の第13イントロンにある潜在的なスプライスアクセプターから、HLF遺伝子の第3イントロンにある潜在的なスプライスドナーにわたって「介在エクソン」が形成されていた。E2A遺伝子の第13エクソンと、HLF遺伝子の第4エクソンとはフレームがあっておらず、「介在エクソン」の存在により両者は同一のリーディングフレームで融合タンパクを発現するものと考えられた。 E2A-HLF融合タンパクは、アミノ末端側がE2Aの転写活性化領域で、「介在エクソン」がコードする領域(J)をへて、HLF因子のDNA結合(B)、ロイシンジッパー領域(ZiP)へとつながるものである(図参照)。このタンパクの生化学的性状を検討するために、われわれは異なる領域を認識する2種類のHLF抗体とE2A抗体を作成した。これらの抗体を用いてUOC-B1細胞より62KDaのE2A-HLF融合タンパクを、HepG2細胞から46KDaのHLFタンパクを、それぞれ免疫沈降法にて同定した。 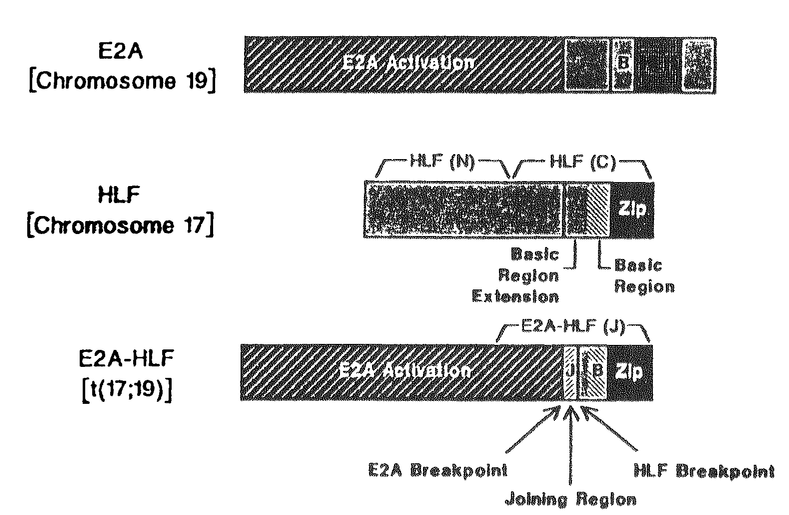 図表 図表 HLFは転写調節因子であるbZIP因子と高いアミノ酸相同性を示し、E2A-HLF融合タンパクはHLFのDNA結合領域を有するため、両者ともに特定のDNA配列に結合することが予想される。HLFの試験管内結合配列を決めるため、大腸菌が産生したHLFまたはE2A-HLFタンパクにランダムオリゴマーを加え、タンパクに特異的に結合したオリゴマーをPCR法にて増幅、この手順を繰り返した後、分離・増幅されたオリゴマーの塩基配列を決めることにより両タンパクの結合配列を決めた。得られた結合配列は、両者とも同一で、GTTACGTAATであり、中央にパリンドローム配列TTACGTAAを含んでいた。次にウサギ網赤血球抽出液を用いた試験管内タンパク合成法により得られたHLF、E2A-HLFタンパクと、末端ラベルしたHLF結合配列を含むオリゴマーを用いて、両タンパクとHLF結合配列の結合をゲルシフト法により証明した。 細胞内に存在するHLF、E2A-HLFタンパクがHLF結合配列に結合するかを検討するために、UOC-B1細胞、HepG2細胞、及び対照として両タンパクともに発現していないNalm-6(ヒト白血病細胞株)から核抽出液を得、ゲルシフト法により分析した。UOC-B1細胞の核抽出液からは、Nalm-6では認められないタンパク/DNA結合バンドが検出され、この結合バンドはE2A抗体、HLF(C)抗体によりスーパーシフトすることから、UOC-B1細胞の核内のE2A-HLFタンパクはHLF結合配列に結合することが示された。一方、HepG2の核抽出液からは、HLFによるタンパク/DNA結合バンドは証明されず、HLFタンパクはE2A-HLFタンパクとは異なり、HepG2細胞内で何らかの制御を受け、HLF結合配列への結合が抑制されているか、もしくは異なる配列に結合する可能性が示唆された。 bZIP因子は自身で二量体をつくり(ホモダイマー)、DNAと結合するほか、他のbZIP因子と二量体をつくり(ヘテロダイマー)、DNAと結合する事が知られている。E2A-HLFはHLFと近縁のbZIP因子であるDBP、TEFと二量体をつくる事が示されており、これらの因子とのヘテロダイマーが発癌に関与している可能性があるため、UOC-B1細胞でのDBP、TEF因子の発現を検討した。ノーザンプロット法によるmRNAの分析では、UOC-B1細胞はいずれのmRMAをも発現していた。しかしながら、DBP抗体、TEF抗体、および両因子と交差活性を有するHLF抗体を用いた免疫沈降法では、いずれのタンパクも検出されなかった。さらに核抽出液をもちいたゲルシフト法でもDBP、TEF由来のタンパク/DNA結合バンドは同定されず、DBP、TEF両因子がUOC-B1細胞の白血化に関与している可能性は小さいと考えられた。 HLF、E2A-HLFの転写促進活性を検討するため、SV40のミニマムプロモーターの上流にHLF結合配列を挿入したCATレポータープラズミドを作成し、HLFまたはE2A-HLFの発現ベクターとともにNalm-6、HepG2、NIH-3T3、293(ヒト胎児腎由来細胞株)の各細胞に導入した。E2A-HLFはこれらのすべての細胞で、転写促進活性を示した。これとは対照的にHLFは293細胞でのみ転写促進活性を示し、Nalm-6、HepG2、NIH-3T3の各細胞では転写活性をもたなかった。この結果はHLFがHepG2細胞内でHLF共通結合配列に結合しないことと合わせ、HLF因子の機能が制御されていることを示唆するものである。 以上の結果より、17:19転座型白血病で発現するE2A-HLF融合転写調節因子は、おそらくホモダイマーで、試験管内HLF結合配列(GTTACGTAAT)、またはそれに近い配列に細胞内でも結合し、ターゲット遺伝子の転写を促進して、分化・増殖にかかわるB細胞系リンパ球の遺伝子プログラムを撹乱し、発癌に至るものと考えられた。 |