| 内容要旨 | | I型コラーゲンは生体内で最も豊富に認められるコラーゲンであり,協調して発現した2本の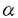 1鎖と1本の 1鎖と1本の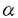 2鎖からなるヘテロトリマーとして存在する.その発現は発生の段階においても厳密な調節を受けており,また組織特異的であることが知られている.多くの病的な線維化をきたす疾患における特徴としてI型コラーゲンの過剰な沈着が観察されており.これは線維化をきたした部位に存在するサイトカインなどの因子に反応して起こるコラーゲン遺伝子の転写活性化の結果としてもたらされる可能性が最も高いと考えられている. 2鎖からなるヘテロトリマーとして存在する.その発現は発生の段階においても厳密な調節を受けており,また組織特異的であることが知られている.多くの病的な線維化をきたす疾患における特徴としてI型コラーゲンの過剰な沈着が観察されており.これは線維化をきたした部位に存在するサイトカインなどの因子に反応して起こるコラーゲン遺伝子の転写活性化の結果としてもたらされる可能性が最も高いと考えられている. I型コラーゲンの転写調節に関しては,これまでにマウス,ヒト,ラット,ニワトリ等いくつかの種において検討されてきた.Goldberg HらはI型コラーゲン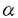 2鎖遺伝子(以下COL1A2)の発現についてレポーター遺伝子を導入したトランスジェニックマウスを用いて検討し,上流プロモーターの-350bpまでの領域があれば組織特異的な発現が起こることを報告した.このプロモーター領域中に,CBF(CCAAT binding factor),マウス線維芽細胞におけるTGF- 2鎖遺伝子(以下COL1A2)の発現についてレポーター遺伝子を導入したトランスジェニックマウスを用いて検討し,上流プロモーターの-350bpまでの領域があれば組織特異的な発現が起こることを報告した.このプロモーター領域中に,CBF(CCAAT binding factor),マウス線維芽細胞におけるTGF-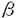 のプロモーター活性化に関わるCTF/NF1ファミリー所属の因子,さらにIF1なる転写抑制因子結合部位などこれまでにいくつかの調節要素とそれらに対応する転写因子が特定されている.最近Inagaki Yらは,ヒトCOL1A2プロモーターを用いた検討によりTGF- のプロモーター活性化に関わるCTF/NF1ファミリー所属の因子,さらにIF1なる転写抑制因子結合部位などこれまでにいくつかの調節要素とそれらに対応する転写因子が特定されている.最近Inagaki Yらは,ヒトCOL1A2プロモーターを用いた検討によりTGF-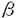 によるCOL1A2の転写調節はヒトとマウスで異なり,Sp1結合部位が関わっている可能性があると報告している.Sp1はヒトI型 によるCOL1A2の転写調節はヒトとマウスで異なり,Sp1結合部位が関わっている可能性があると報告している.Sp1はヒトI型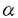 1鎖遺伝子(以下COL1A1)においてもTGF- 1鎖遺伝子(以下COL1A1)においてもTGF-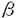 による転写活性化への関わりが報告されているが,ラットCOL1A1では異なった因子の関わりが想定されている.このように,I型コラーゲン遺伝子の転写レベルでの調節はCOL1A1とCOL1A2で異なっている可能性があり,また種によっても異なっている可能性がある.このようにコラーゲン遺伝子の発現調節は種特異的である可能性があるため,ヒトにおいて生ずる線維化に関わるマトリックス遺伝子の調節機構の理解のためには,ヒト線維芽細胞を用いて非刺激時やサイトカイン刺激時の転写メカニズムを解明することが不可欠である. による転写活性化への関わりが報告されているが,ラットCOL1A1では異なった因子の関わりが想定されている.このように,I型コラーゲン遺伝子の転写レベルでの調節はCOL1A1とCOL1A2で異なっている可能性があり,また種によっても異なっている可能性がある.このようにコラーゲン遺伝子の発現調節は種特異的である可能性があるため,ヒトにおいて生ずる線維化に関わるマトリックス遺伝子の調節機構の理解のためには,ヒト線維芽細胞を用いて非刺激時やサイトカイン刺激時の転写メカニズムを解明することが不可欠である. 最近筆者の所属した研究グループは,汎発性強皮症患者由来の線維芽細胞は,健常人由来の線維芽細胞に比べて高い転写活性を示すことを報告した.この汎発性強皮症患者由来線維芽細胞のCOL1A2プロモーターの活性化に関わる領域は-376bpと-108bpの間に存在すると考えられている.このプロモーター領域についてさらに検討を加えたところ.いわゆるSp1結合部位を含むGCリッチ領域が非刺激時のプロモーター活性において重要であることが示された.そこでこのGCリッチ領域の機能についてより詳細な検討を加え.ヒトCOL1A2における非刺激時の転写調節について更なる知見を得ることを試みた. まず,ヒトCOL1A2プロモーター中-376から-108までの領域の機能についてさらに詳しい情報を得るために,-323,-299,-289,-264,-186の5種類の欠失変異体-CATリポーター遺伝子プラスミドを作成しヒト包皮線維芽細胞に一過的にトランスフェクトしてそれぞれのプロモーター活性を測定したところ-289bpまでの欠失はプロモーター活性に影響を与えなかったが,-264bpまで欠失させるとプロモーター活性が12.8%に低下し(p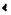 0.0001),-289bpから-264bpまでの領域が非刺激時の転写活性において重要であることが示唆された.このプロモーター領域は転写因子Sp1のコンセンサス配列に類似するGCリッチ配列(GCボックス)を含んでいた.さらに,ほとんど同一のGCボックスがこの領域よりやや上流の-303bpと-288bpの2箇所に認められた. 0.0001),-289bpから-264bpまでの領域が非刺激時の転写活性において重要であることが示唆された.このプロモーター領域は転写因子Sp1のコンセンサス配列に類似するGCリッチ配列(GCボックス)を含んでいた.さらに,ほとんど同一のGCボックスがこの領域よりやや上流の-303bpと-288bpの2箇所に認められた. このGCリッチ領域に結合するトランス因子を同定するためにCOL1A2の-353から-234までのDNA断片をプローブとしてヒト包皮線維芽細胞より得た核抽出液にてDNase I フットプリンティングを行ったところ核抽出液の添加により3箇所のGCボックスとその上流約10bpまでの部分を含む60bpにおよぶ広範なプロテクションが認められた.3箇所のGCボックスすべてにSp1の結合を阻害する部位特異的変異を導入したプローブではプロテクションが一部を除いて認められなくなったこと,Sp1コンセンサス配列オリゴヌクレオチドおよび3箇所のGCボックスの部分のみを含む39bp(-306から-268まで)のDNA断片による競合下でも同様にプロテクションの消失が認められたことよりSp1結合配列の関与が示唆された. さらにこの領域に結合する因子について解析するために,同じプローブを用いたゲルシフトアッセイを行ったところ,最上部に近接して3本の特異的なバンドが認められた.これら3本のバンドは3箇所のGCボックスの部分のみを含む39bp(-306から-268まで)のDNA断片の競合により消失することから,この39bpの範囲内への結合であると考えられた.またSp1コンセンサス配列による競合では中央のバンドのみが消失し,Sp1もしくはSp1に関連した結合因子の関与が示唆された. 次に,GCリッチ領域に結合する蛋白とSp1との免疫学的な関連を見るために,ウサギ抗Sp1抗体存在下にゲルシフトアッセイを行ったところコンセンサス配列の競合の結果と矛盾なく中央のバンドのみが消失した.さらにゲルシフトアッセイでシフトしたバンド中に存在するDNA結合蛋白をニトロセルロースフィルターに転写し,抗Sp1抗体を用いて検出を試みたところ,オートラジオグラフィー上中央のバンドとほぼ一致した部分にブロットでも抗Sp1抗体にて検出される蛋白が認められ,中央のバンドを構成する蛋白がSp1に免疫学的に関連していることが立証された. 次にGCボックスがCOL1A2プロモーター活性に及ぼす機能を解析するため,-353欠失変異体をもとにGCボックスの部位特異的変異を個々もしくは複数のボックスについて導入した変異リポータープラスミドを作成し,ヒト包皮線維芽細胞に一過的にトランスフェクトしてCATアッセイを行ったところ.欠失変異体を用いた実験の結果と矛盾なく,1番目のボックス.2番目のボックスに単独で変異を導入してもプロモーター活性に有意な影響は認められなかったが,3番目のボックスに変異を導入したところプロモーター活性が30%程度低下した.さらに2番目と3番目に変異を導入したところ,50%程度の低下となり,3箇所すべてのGCボックスに変異を導入するとプロモーター活性は12.2%まで低下し,3箇所すべてを欠失変異によって欠いた-264変異体の結果に相当した.また,GCボックスに導入した部位特異的変異が,DNA-蛋白複合体形成に及ぼす影響をゲルシフトアッセイを用いて解析したところ,単一のGCボックスに変異を導入してもほとんどバンド形成に影響は認められなかったが,2番目,3番目の2箇所のボックスに導入するとある程度複合体の形成が減少し,すべてのボックスに導入すると結合はほぼ消失した. 本論文において筆者はヒト線維芽細胞においてプロモーター活性の主要部分を担当する要素としてヒトCOL1A2プロモーターのGCリッチ領域を特定した.この領域中に転写因子Sp1の認識部位に酷似した3箇所の結合部位(GCボックス)が同定され,部位特異的変異体を用いたCATアッセイの結果より,これら結合部位のそれぞれがCOL1A2プロモーター活性に寄与しており,全体としてin vivoにおける活性の大部分(90%)を担っていることが示された. このDNA断片には,DNase I フットプリンティングで広範囲のプロテクションが認められたことや,ゲルシフトアッセイで複数のDNA-蛋白複合体が形成されたことより,複雑なDNAと蛋白間の相互作用が存在すると考えられる.複数の蛋白が関与すると考えられるこの複合体について筆者は,その1つを構成するのが転写因子Sp1でありDNAへの結合に不可欠であることを証明し得た.これは以下の3つの知見を根拠とする.(1)DNase I フットブリンティングで認められるGCリッチ領域のプロテクションがSp1コンセンサス配列に競合して消失すること.(2)ゲルシフトアッセイで認められるDNA-蛋白複合体の1つの形成がSp1コンセンサス配列および抗Sp1抗体の双方によって阻害されること.(3)抗Sp1抗体はゲルシフトでSp1コンセンサス配列により形成の阻害されるバンド(中央のバンド)を認識すること. Sp1は普遍的に存在する転写因子であり,多数のウィルスまたは細胞由来プロモーターの調節に関わっていることが示されている.I型コラーゲンの非刺激時の転写調節におけるSp1の役割としては過去にCOL1A1に関していくつかの報告が成されているが,トランスフェクションに用いた細胞の種類によりSp1の効果について逆の結果が得られるなど未解明の点が多かった.ヒトCOL1A2およびヒト線維芽細胞を用いた筆者の実験系においては,Sp1がCOL1A2プロモーターの強力な活性化因子である複合体の一角を成すことが証明されたと言える. |
| 審査要旨 | | 本研究は汎発性強皮症の転写活性化に関わる可能性が示唆されているI型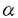 2鎖コラーゲン遺伝子(COL1A2)プロモーターの-376bpと-108bpの間の領域についてヒト包皮由来線維芽細胞を用いて転写調節に関する詳細な検討を加えることを目的としたものであり,下記の結果を得ている。 2鎖コラーゲン遺伝子(COL1A2)プロモーターの-376bpと-108bpの間の領域についてヒト包皮由来線維芽細胞を用いて転写調節に関する詳細な検討を加えることを目的としたものであり,下記の結果を得ている。 1.-323,-299,-289,-264,-186の5種類の欠失変異体-CATリポーター遺伝子プラスミドを作成しヒト包皮線維芽細胞に一過的にトランスフェクトしてそれぞれのプロモーター活性を測定したところ-289bpまでの欠失はプロモーター活性に影響を与えなかったが,-264bpまで欠失させるとプロモーター活性が12.8%に低下し(p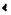 0.0001),-289bpから-264bpまでの領域が非刺激時の転写活性において重要であることが示峻された. 0.0001),-289bpから-264bpまでの領域が非刺激時の転写活性において重要であることが示峻された. 2.COL1A2の-353から-234までのDNA断片をプローブとしてヒト包皮線維芽細胞より得た核抽出液にてDNase I フットプリシティングを行ったところ核抽出液の添加により3箇所のGCボックスとその上流約10bpまでの部分を含む60bpにおよぶ広範なプロテクショシが認められた.3箇所のGCボックスすべてにSp1の結合を阻害する部位特異的変異を導入したプローブではプロテクションが一部を除いて認められなくなったこと,Sp1コンセンサス配列オリゴヌクレオチドおよび3箇所のGCボックスの部分のみを含む39bp(-306から-268まで)のDNA断片による競合下でも同様にプロテクショシの消失が認められたことよりSp1結合配列の関与が示唆された. 3.同じプローブを用いたゲルシフトアッセイを行ったところ,最上部に近接して3本の特異的なバンドが認められた.これら3本のバンドは3箇所のGCボックスの部分のみを含む39bp(-306から-268まで)のDNA断片の競合により消失することから,この39bpの範囲内への結合であると考えられた.またSp1コンセンサス配列による競合では中央のバンドのみが消失し,Sp1もしくはSp1に関連した結合因子の関与が示唆された. 4.ウサギ抗Sp1抗体存在下にゲルシフトアッセイを行ったところコンセンサス配列の競合の結果と矛盾なく中央のバンドのみが消失した.さらにゲルシフトアッセイでシフトしたバンド中に存在するDNA結合蛋白をニトロセルロースフィルターに転写し,抗Sp1抗体を用いて検出を試みたところ,オートラジオグラフィー上中央のバンドとほぼ一致した部分にブロットでも抗Sp1抗体にて検出される蛋白が認められ,中央のバンドを横成する蛋白がSp1に免疫学的に関連していることが立証された. 5.-353欠失変異体をもとにGCボックスの部位特異的変異を個々もしくは複数のボックスについて導入した変異リポータープラスミドを作成し,ヒト包皮線維芽細胞に一過的にトランスフェクトしてCATアッセイを行ったところ,欠失変異体を用いた実験の結果と矛盾なく,1番目のボックス,2番目のボックスに単独で変異を導入してもプロモーター活性に有意な影響は認められなかったが,3番目のボックスに変異を導入したところプロモーター活性が30%程度低下した.さらに2番目と3番目に変異を導入したところ,50%程度の低下となり,3箇所すべてのGCボックスに変異を導入するとプロモーター活性は12.2%まで低下し,3箇所すべてを欠失変異によって欠いた-264変異体の結果に相当した. 6.GCボックスに導入した部位特異的変異が,DNA-蛋白複合体形成に及ぼす影響をゲルシフトアッセイを用いて解析したところ,単一のGCボックスに変異を導入してもほとんどバンド形成に影響は認められなかったが,2番目,3番目の2箇所のボックスに導入するとある程度複合体の形成が減少し,すべてのボックスに導入すると結合はほぼ消失した. 以上,本論文はヒトCOL1A2プロモーター領域の詳細な解析により,ヒト線維芽細胞においてSp1がCOL1A2プロモーターの強力な活性化因子である複合体の一角を成すことを証明した。本研究はコラーゲン遺伝子の転写制御機構の解明に重要な貢献を成し,こうした知見の集積によって最終的には汎発性強皮症等の疾患における転写活性化機構の解明,さらにはこうした疾患の遺伝子治療的アプローチへつながっていくことが考えられ,学位の授与に値するものと考えられる。 |