エンドセリン(以下ETと省略)はブタ血管内皮細胞の培養上清中より単離された、強力かつ持続的な血管収縮活性を有する、21アミノ酸からなるペプチドである。ヒトET-1は203アミノ酸からなる前駆体(preproET-1)として合成された後、38アミノ酸のET-1生合成中間体であるbigET-1に変換され、bigET-1はさらにエンドセリン変換酵素(endothelin-converting enzyme;以下ECEと省略)というプロテアーゼによって21番目のTrpと22番目のValの間が切断され、成熟型ET-1に変換される。BigET-1の生物活性はET-1のそれに比べて100分の1以下であることから、ECEはET生合成のkey enzymeとして機能する生理的に重要な酵素であると考えられるが、本研究の開始当初はその一次構造も未知であった。本研究ではECEに関して、分子生物学的、免疫学的手法を用いてその一次構造、活性、構造-活性相関、組織分布、細胞内局在性などについて検討を加えた。 まず精製ラットECEの部分アミノ酸配列を決定し、その情報を基にしてラット肺血管内皮細胞(TRLEC-03)のcDNA libraryからECE-1 cDNAを単離することに成功し、その一次構造を明らかにした。ECE-1はN末端付近に1箇所の膜貫通領域を有し、C末側領域に亜鉛結合領域を持つ金属プロテアーゼであり、他の中性金属プロテアーゼであるneutral endopeptidase-24.11(NEP)やヒト赤血球の表面抗原であるKell blood group protein(KELL)とアミノ酸配列上有意な相同性が認められた。ECE-1は全分子量の約1/3が糖鎖からなる糖蛋白であるが、これに対応してECE-1アミノ酸配列内には10箇所のアスパラギン結合型糖鎖の付加しうるコンセンサス配列が存在した。またアミノ酸配列内には14個のシステイン残基が存在し、それらのうち10個がNEPやKELLでも保存されていたことから、これら3つの蛋白は一次構造のみならず高次構造も類似していると考えられた。ECE-1 cDNAを発現させたCOS-1細胞の膜画分にはbig ETsをETsに変換する活性が検出され、この活性はフォスフォラミドンによって阻害されたがチオルファンでは阻害されなかった。またbig ETイソフォームの中ではbig ET-1を最も効率良く変換した。これらの結果はこれまで細胞やその粗抽出液を用いて明らかにされてきたECEに関する知見と一致するものであった。また精製ラットECEを抗原として二種類の抗ECEモノクローナル抗体を作製し、これを使用したウエスタンプロッティングによって、ECE-1 cDNAを導入したCOS-1細胞の膜画分にECE-1の発現が確認された。またECE-1 cDNAをプローブとして用いたノーザンブロッティングの結果、ECE-1は血管内皮細胞、肺、及び副腎に多く発現しており、他の組織にも若干の発現が認められた。 ECE-1を還元あるいは非還元条件下でSDS-PAGEを行なった後、抗ECE抗体でウエスタンプロッティングを行なうと、ECE-1の分子量は還元条件下では約130kDaの位置に泳動されるのに対し非還元条件下では約300kDaの位置に泳動された。またラット肺ミクロソーム画分をクロスリンクし還元条件下でSDS-PAGEを行なった後、ウエスタンプロッティングを行なうと、クロスリンカーの濃度依存的にECEの分子量は300kDaへ変化した。以上の結果から、ECE-1はジスルフィド結合を介した二量体を形成していることが明らかになった。さらにECE-1とNEPの一次構造及びそれらのSDS-PAGE上の移動度の比較から、ECE-1の二量体形成に関与するシステイン残基はECE-1に存在する14個のうち、NEPでは保存されていない4個のうちのいずれかであると推測した。そこでこれら4個のシステイン残基をそれぞれセリン残基に置換した変異酵素を部位特異的変異によって作製し、これら変異酵素の還元、あるいは非還元条件下でのSDS-PAGE上の移動度を比較することによって、ECE-1の二量体形成に関与するシステイン残基はCys412であると同定した。C412S変異酵素のVmax値、Km値は野生型酵素に比べそれぞれ1/2、5倍であったことから、ECE-1の二量体構造は基質との親和性の向上に寄与し、big ETsを効率的に変換するのに重要であることが明らかになった。またNEPにおいてその活性や基質結合に重要な役割を果たすアミノ酸残基は既に明らかにされているが、ECE-1とNEPとのアミノ酸配列の比較からこれらに対応するECE-1のアミノ酸を特定し、部位特異的変異法によって他のアミノ酸に置換した変異酵素を作製した。これら変異酵素の性質を解析した結果、ECE-1のGlu592は酵素活性に最も重要な活性中心の残基であり、その周辺のヒスチジン残基が亜鉛結合の2つのリガンドであること、Glu651は亜鉛結合の3番目のリガンドであること、His716は遷移状態の基質の安定化に関与していることが明らかになった。これらのことはいずれもNEPでの結果と一致する。一方、NEPにおいて基質結合に関与することが明らかになっているアミノ酸残基に対応するECE-1のArg129とGlu752は、ECE-1ではいずれも基質結合には関与しないと考えられた。これらことから、ECE-1とNEPとではプロテアーゼとしての基本的な触媒機構は保存されているが、それらの基質認識機構は互いに異なることが示唆された。 次にラットECE-1 cDNAをプロープとしてHUVEC cDNA libraryからヒトECE-1 cDNAをクローニングし、その一次構造を明らかにした。ヒトECE-1はラットやウシのECE-1とアミノ酸レベルで90%以上の相同性を有していたことから、ECE-1は種を越えて高度に保存されていることが明らかとなった。ヒトECE-1 cDNAを導入したCOS-1細胞の膜画分にもラットの場合と同様にECE活性が検出され、またヒトECEとも交差反応性を示す抗ECEモノクローナル抗体を用いたウエスタンプロッティングによっても発現が確認された。 この時点までに他の研究室においてクローニングされていたECE-1のアミノ酸配列を比較すると、ウシ及びヒトにおいてN末端アミノ酸配列のみを異にする2種類のイソフォームがあることが推定された。このことが種を越えた普遍的事実であることを証明するため、ラット肺からももう一つのECE-1 cDNAの5’末端をRT-PCR法によってクローニングし、これら2つのイソフォームをそれぞれECE-1 、及びECE-1 、及びECE-1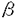 と命名した。ECE-1 と命名した。ECE-1 と-1 と-1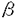 とは比活性、基質特異性、SDS-PAGE上の移動度(糖鎖付加の程度)、細胞内局在部位などには違いが見られなかった。ラットの各種臓器のRNAを基にしたcompetitive PCR法による解析の結果、調べた限りいずれの臓器においてもECE-1 とは比活性、基質特異性、SDS-PAGE上の移動度(糖鎖付加の程度)、細胞内局在部位などには違いが見られなかった。ラットの各種臓器のRNAを基にしたcompetitive PCR法による解析の結果、調べた限りいずれの臓器においてもECE-1 の方が-1 の方が-1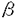 よりも多く発現していた。これらの結果から、生理的に重要なECE-1はECE-1 よりも多く発現していた。これらの結果から、生理的に重要なECE-1はECE-1 であると考えられた。ECE-1 であると考えられた。ECE-1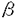 がminor formとして存在する生理的意義は今のところ明確ではない。 がminor formとして存在する生理的意義は今のところ明確ではない。 抗ECEモノクローナル抗体を用いた免疫組織染色の結果、ECEは大動脈や肺を含めた種々の組織において、血管内皮細胞に局在していることが明らかになった。ECE-1を発現させたCOS-1細胞あるいはCHO細胞の培養上清中にbig ETsを加えたところ、効率良くETsに変換された。またこの抗体はECE-1の膜貫通領域よりもC末側を認識するが、共焦点レーザー免疫蛍光顕微鏡を用いてこれらの細胞を観察すると、主に細胞表層が染色された。以上の結果から、ECE-1は活性領域を細胞外に露出した状態で形質膜上に存在することが明らかになった。またきわめて特徴的な局在様式として、ECE-1は形質膜上にクラスターを形成していることが明らかになった。C412SR異酵素も同様の細胞内局在を示した。ECEは血管内皮細胞以外では副腎髄質のクロマフィン細胞や膵臓ランゲルハンス島の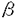 細胞、睾丸の間質細胞に発現が認められた。 細胞、睾丸の間質細胞に発現が認められた。 以上の知見を基にしたECE-1分子のモデル構造を図に示す。ECE-1はC末側活性領域を細胞外に向けN末端を細胞内に残した状態で、主に血管内皮細胞の形質膜上にクラスター構造を形成して存在する。C末側細胞外領域には10箇所のアスパラギン結合型糖鎖が結合しうるコンセンサス配列があり、全分子量の1/3が糖鎖で占められている。ECE-1にはN末端細胞内領域のアミノ酸配列を異にする 型及び 型及び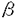 型の二種類のイソフォームが存在するが、 型の二種類のイソフォームが存在するが、 型の方が主要な形態である。ECE-1はCys412を介したジスルフィド結合によって二量体を形成しているが、ホモ二量体( 型の方が主要な形態である。ECE-1はCys412を介したジスルフィド結合によって二量体を形成しているが、ホモ二量体(  または または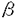 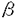 )またはへテロニ量体( )またはへテロニ量体( 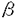 )の両者が存在しうる。それぞれのサブユニットはHis591、His995、及びGlu651の3つのアミノ酸によって亜鉛原子を1個配位しており、Glu592が活性中心として機能する一方、His716は遷移状態の基質の安定化に寄与する。 )の両者が存在しうる。それぞれのサブユニットはHis591、His995、及びGlu651の3つのアミノ酸によって亜鉛原子を1個配位しており、Glu592が活性中心として機能する一方、His716は遷移状態の基質の安定化に寄与する。 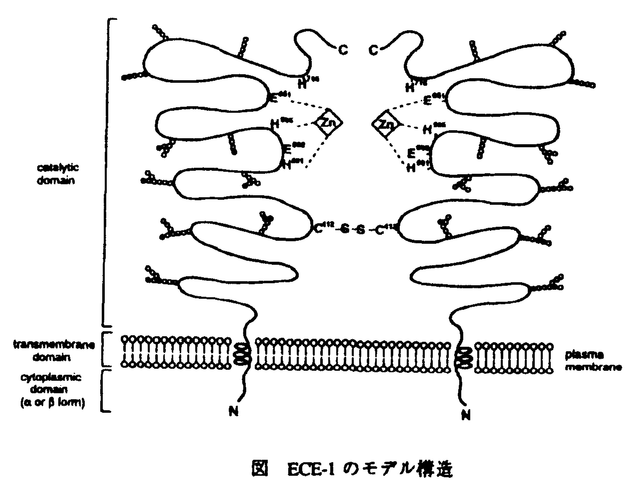 図 ECE-1のモデル構造 図 ECE-1のモデル構造 ECE阻害剤はETが関与すると考えられている高血圧や心不全などの疾患に対する治療薬としての臨床応用が期待されるが、本研究の結果はECE阻害剤を開発する上で重要な情報になるものと思われる。 |